题目内容
6.亚氯酸钠( NaClO2)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等.已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.纯ClO2易分解爆炸.一种制备亚氯酸钠粗产品的工艺流程如下:
(1)ClO2发生器中的离子方程式为2ClO3-+SO2=2ClO2↑+SO42-,发生器中鼓人空气的作用可能是b(选填序号).
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑,吸收塔的温度不能超过20℃,其原因是防止H2O2分解.
(3)从“母液”中可回收的主要物质是Na2SO4.
(4)从吸收塔中可获得NaClO2溶液,从NaClO2溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④低于60℃干燥,得到成品.
(5)为测定粗品中NaClO2的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+Cl-).将所得混合液配成250mL待测溶液,取25.00mL待测液,用2.000mol.L-l Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),滴定终点的现象为滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色.
分析 NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,同时得到Na2SO4,然后与过氧化氢在碱性条件下反应生成NaClO2,将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO3,母液中主要含有Na2SO4,
(1)ClO2发生器中发生反应:2NaClO3+SO2=2ClO2↑+Na2SO4,纯ClO2易分解爆炸,稀释ClO2以防止爆炸;
(2)吸收塔内是ClO2与氢氧化钠、过氧化氢反应生成NaClO2,过氧化氢起还原剂作用生成氧气;低于38℃析出NaCl02•3H2O,实际控制温度20℃,可能是温度过高时过氧化氢发生分解;
(3)从“母液”中可回收的主要物质是硫酸钠;
(4)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制,防止NaClO2分解成NaClO3和NaCl,防止析出NaCl02•3H2O晶体;
(5)发生反应为I2+2S2O32-=2I-+S4O62-,该反应中有碘单质参与,可采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,开始时溶液为蓝色,反应结束时变为无色,据此判断滴定终点.
解答 解:NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,同时得到Na2SO4,然后与过氧化氢在碱性条件下反应生成NaClO2,将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO3,母液中主要含有Na2SO4,
(1)ClO2发生器中发生反应:2NaClO3+SO2=2ClO2↑+Na2SO4,反应离子方程式为:2ClO3-+SO2=2ClO2↑+SO42-,纯ClO2易分解爆炸,稀释ClO2以防止爆炸,
故答案为:2ClO3-+SO2=2ClO2↑+SO42-;b;
(2)吸收塔内是ClO2与氢氧化钠、过氧化氢反应生成NaClO2,过氧化氢起还原剂作用生成氧气,反应方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;低于38℃析出NaCl02•3H2O,实际控制温度20℃,可能是防止温度过高时过氧化氢发生分解,
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;防止H2O2分解;
(3)从“母液”中可回收的主要物质是Na2SO4,
故答案为:Na2SO4;
(4)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,为防止析出晶体NaClO2•3H2O,应趁热过滤,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;用38℃~60℃热水洗涤;
(5)有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,发生反应为:I2+2S2O32-=2I-+S4O62-,滴定结束前溶液为蓝色,滴定结束时变为无色,则滴定终点的现象为:滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色,
故答案为:滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色.
点评 本题考查物质制备实验,涉及物质分离提纯、氧化还原反应、物质含量测定、信息获取与运用等,侧重学生综合应用能力,题目难度中等,明确实验目的、实验原理为解答关键.

①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧熔点:Li<Na<K<Cs.
| A. | ①⑤⑧ | B. | ②④⑤⑥⑦ | C. | ①③⑤⑧ | D. | ②④⑥⑧ |
| A. | SO2和O2 | B. | H2和HCl | C. | H2S和HCl | D. | Cl2和HCl |
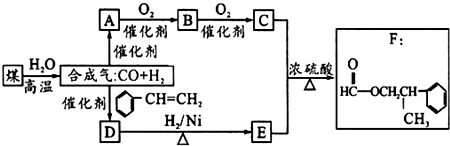
| A. | CO(g)+2H2(g)═CH3OH(l) | |
| B. | 2Cu(s)+O2(g)═2CuO(s) | |
| C. | NH3(g)+HCl(g)═NH4Cl(s) | |
| D. | CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l) |
| A. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-乙基己烷 | |
| B. | 硬脂酸甘油酯和油酸甘油酯互为同系物 | |
| C. | 三硝基甲苯的分子式为C7H5N3O6 | |
| D. | 淀粉与纤维素的化学式为(C6H10O5)n,但两者不是同分异构体 |
| A. | 该原电池的正极是锌 | B. | 铜电极发生还原反应 | ||
| C. | 原电池中Cu2+向锌极移动 | D. | 铜极有气体放出 |




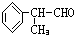
 .
. 、
、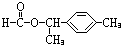 .
.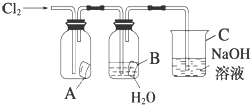 某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.
某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.