题目内容
18.氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如图1,完成下列填空: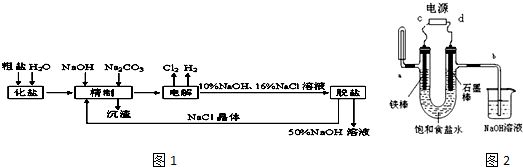
(1)在电解过程中,与电源负极相连的电极上电极反应为2H++2e-=H2↑,与电源正极相连的电极附近,溶液pH下降(选填“不变”、“升高”或“下降”).
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为Ca2++CO32-═CaCO3↓,Mg2++2OH-═Mg(OH)2↓.
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是A.
A.BaCl2 B.Ba(NO3)2 C.BaCO3
(4)用以如图2装置电解饱和食盐水时a处收集到的气体是H2U型管左边铁棒附近滴入紫色石蕊颜色变化为变蓝,C为电源的负极.B处导气管中产生的气体可用淀粉碘化钾试纸检验.
(5)电解足够长时间后发现相同条件下a出和b处产生的气体体积比接近2:1,此时将电源正负极互换则U型管内现象是先出现白色沉淀,后转化为红褐色沉淀.
分析 (1)电解饱和食盐水的原理方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,电解食盐水,与正极相连为阳极,生成氯气,与电源负极相连为阴极,生成氢气和NaOH;
(2)用可溶性的碳酸钠除去钙离子,用NaOH除去镁离子;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;
(4)氢气的收集可以采用向上排空气法,消耗氢离子,电极附近溶液pH升高,与电源负极相连为阴极,氯气的检验可以用淀粉碘化钾溶液,据此回答;
(5)电解足够长时间后发现相同条件下a出和b处产生的气体体积比接近2:1,此时为电解水,溶质为氢氧化钠,将电源正负极互换,铁作阳极,铁失去电子生成亚铁离子,亚铁离子和碱反应生成氢氧化亚铁,白色的氢氧化亚铁被氧气氧化生成红褐色的氢氧化铁.
解答 解:(1)电解氯化钠溶液时,阳极是氯离子失电子生成氯气的过程,电极反应式为2Cl--2e-=Cl2↑,该电极生成的氯气部分溶解与水反应生成酸,电极附近PH下降,阴极是氢离子的电子生成氢气的过程,发生电极反应:2H++2e-=H2↑,该极消耗氢离子,电极附近溶液pH升高,
故答案为:2H++2e-=H2↑;下降;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,离子反应分别为Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,
故答案为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓;
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂选择的原则是不引入难以除去的杂质离子;
A.BaCl2,加入过量试剂硫酸根离子全部沉淀,氯离子不是杂质离子,故A符合;
B.Ba(NO3)2,加入过量试剂,硝酸根离子不能除去,引入杂质离子硝酸根,故B不符合;
C.BaCO3 为难溶于水的盐,与硫酸根离子几乎不反应,故C不符合;
故答案为:A;
(4)根据图示气态产物的收集方法可知:a处试管中收集的是氢气,阴极是氢离子的电子生成氢气的过程,发生电极反应:2H++2e-=H2↑,该极消耗氢离子,电极附近氢氧根离子浓度增大,滴入紫色石蕊颜色,显示蓝色,与电源负极相连为阴极,C为电源的负极,阳极是氯离子失电子生成氯气的过程,电极反应式为2Cl--2e-=Cl2↑,氯气可以使湿润的淀粉碘化钾试纸变蓝色,方程式为2KI+Cl2=2KCl+I2,生成的碘单质与淀粉显示蓝色,
故答案为:变蓝;负极;淀粉碘化钾试纸;
(5)电解足够长时间后发现相同条件下a出和b处产生的气体体积比接近2:1,此时为电解水,溶质为氢氧化钠,a处试管中收集的是氢气,为阴极,与电源负极相连,将电源正负极互换,铁作阳极,电极反应为:2Fe-4e-=2Fe2+,阴极石墨,电极反应为:2H2O+O2+4e-=4OH-,总反应为2Fe+2H2O+O2═2Fe(OH)2,出现白色沉淀,白色的氢氧化亚铁被氧气氧化生成红褐色的氢氧化铁,反应为:4Fe(OH)2+2H2O+O2═4Fe(OH)3,所以现象为:先出现白色沉淀,后转化为红褐色沉淀,
故答案为:先出现白色沉淀,后转化为红褐色沉淀.
点评 本题考查混合物分离提纯的综合应用及海水资源利用等,为高频考点,把握分离流程中的反应及混合物分离方法以及电解原理为解答的关键,侧重分析与应用能力的考查,题目难度中等.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案绿色植物是空气天然的“净化器”,研究发现,10000m2柳杉每月可以吸收160kgSO2,则100 m2柳杉每月吸收的SO2的物质的量为
A.2.5mol B.5mol C.25mol D.250mol
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
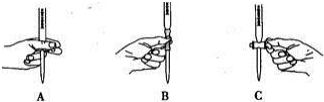
(2)滴定过程中操作滴定管的图示正确的是A.
(3)若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2是…. b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4探究催化剂对该反应速率的影响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O(离子方程式表示).
| A. | 未知浓度酸液用滴定管量取,滴定管用蒸馏水洗涤后,没用待测酸液润洗 | |
| B. | 装待测液的锥形瓶用蒸馏水洗涤后,没用待测液冲洗 | |
| C. | 量取酸液的体积时,开始仰视凹液面,取液结束时俯视凹液面 | |
| D. | 滴定开始滴定管尖端有气泡,到达终点时尖端无气泡 |
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数多 | |
| C. | 5.2g 26Al3+中所含的电子数约为6.02×1024 | |
| D. | 26Al和26Mg的质子数和核外电子数均不相同,中子数相同 |
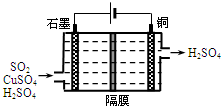 一种以铜作催化剂脱硫有如下两个过程:
一种以铜作催化剂脱硫有如下两个过程: