题目内容
1.如图所示,A、B、C是常用的三种制备气体的装置,D是多用途瓶.
实验室提供的药品有:锌粒、二氧化锰、生石灰、浓盐酸、过氧化氢、稀盐酸、浓硫酸、浓氨水.请根据提供药品和装置回答下列问题:
(1)①实验室制备氨气,可选用的装置是B(填序号).
②用D装置排空法收集氢气时,气体从b口入;除去氢气中的水蒸气,装置D中加入的试剂名称为浓硫酸.
③实验室制取氧气所选试剂的化学式为MnO2、H2O2.
(2)①写出实验室制取氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
②检验C装置气密性的实验操作方法是关闭分液漏斗的活塞,将导管插入水槽的水中,给烧瓶微热,导管口有气泡冒出,撤去热源后,导管有一端液柱产生,且保持一段时间,证明气密性良好.
(3)将97.5g锌投入一定量的浓硫酸中,锌完全反应,当产生的气体通过足量酸性KMnO4溶液时,现象为紫红色变浅或褪色,而后又收集到11.2L气体(标准状况),则参加反的硫酸的物质的量为2.5mol.
分析 (1)①实验室用氯化铵和氢氧化钙加热制备氨气,据此判断反应装置;
②氢气的密度小于空气,导管需要采用短进长出的方式;用装置D干燥氢气,需要用液态干燥剂,通常用浓硫酸;
③实验室中可以用双氧水分解的方法制取少量氧气;
(2)①实验室中用二氧化锰与浓盐酸加热的方法制备氯气,离子方程式中浓盐酸中的HCl应该拆开;
②关闭分液漏斗的活塞,将导管插入水槽的水中,稍加热烧瓶,根据导管口是否有气泡冒出及撤去热源后导管是否有一端液柱产生可判断该装置气密性;
(3)锌与浓硫酸反应生成二氧化硫气体,二氧化硫能够使酸性高锰酸钾溶液褪色,据此判断反应现象;收集到的11.2L气体为氢气,结合锌的物质的量利用电子守恒、质量守恒计算出参与反应的硫酸的物质的量.
解答 解:(1)①氯化铵和氢氧化钙加热制备氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,则应该选用装置B作为反应装置,
故答案为:B;
②用D装置排空法收集氢气时,由于氢气密度小于空气,则气体应该从b口入;除去氢气中的水蒸气,可以选用浓硫酸做干燥剂,
故答案为:b;浓硫酸;
③实验室中,可以用二氧化锰作催化剂分解双氧水获得氧气,所以选用的试剂为:MnO2、H2O2,
故答案为:MnO2、H2O2;
(2)①实验室用浓盐酸与二氧化锰加热制取氯气,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②检验装置C的气密性是否良好的方法为:关闭分液漏斗的活塞,将导管插入水槽的水中,给烧瓶微热,导管口有气泡冒出,撤去热源后,导管有一端液柱产生,且保持一段时间,证明气密性良好,
故答案为:关闭分液漏斗的活塞,将导管插入水槽的水中,给烧瓶微热,导管口有气泡冒出,撤去热源后,导管有一端液柱产生,且保持一段时间,证明气密性良好;
(3)97.5g锌的物质的量为:$\frac{97.5g}{65g/mol}$=1.5mol,标准状况下11.2L气体的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
产生的气体中含有二氧化硫,当通过足量酸性KMnO4溶液时,会观察到紫红色变浅或褪色;
锌与浓硫酸反应时,先生成二氧化硫气体,然后锌与稀硫酸反应生成氢气,氢气不与酸性高锰酸钾溶液反应,所以生成氢气的物质的量为0.5mol,根据电子守恒可知消耗锌的物质的量为:$\frac{0.5mol×2}{2}$=0.5mol,
则生成二氧化硫消耗锌的物质的量为:1.5mol-0.5mol=1mol,根据电子守恒,1mol锌完全反应生成二氧化硫的物质的量为:$\frac{1mol×2}{6-4}$=1mol,则1mol锌与浓硫酸反应生成1mol二氧化硫、1mol硫酸锌,总共消耗硫酸的总物质的量为:1mol+1mol=2mol,
所以反应中消耗硫酸的总物质的量为:2mol+0.5mol=2.5mol,
故答案为:紫红色变浅或褪色;2.5mol.
点评 本题考查了制备方案的设计,题目难度中等,设计常见气体的制备装置、反应原理、收集方法及离子方程式书写、化学计算等知识,明确常见气体的性质及制备方法为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | 分子中3个碳原子在同一直线上 | |
| B. | 分子中所有原子都在同一平面上 | |
| C. | 分子中共价键的夹角为120° | |
| D. | 分子中共价键数为8,其中有一个碳碳双键 |
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
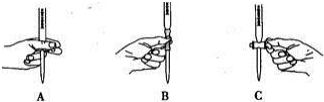
(2)滴定过程中操作滴定管的图示正确的是A.
(3)若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2是…. b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4探究催化剂对该反应速率的影响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O(离子方程式表示).
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
探究浓度对化学反应速率的影响,应选择①②或①③或④⑤(填实验编号);
若同时选择①②③溶液变浑浊的时间,探究比较改变不同反应物浓度对反应速率的影响对化学反应速率的影响.
| A. | 未知浓度酸液用滴定管量取,滴定管用蒸馏水洗涤后,没用待测酸液润洗 | |
| B. | 装待测液的锥形瓶用蒸馏水洗涤后,没用待测液冲洗 | |
| C. | 量取酸液的体积时,开始仰视凹液面,取液结束时俯视凹液面 | |
| D. | 滴定开始滴定管尖端有气泡,到达终点时尖端无气泡 |
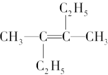 的命名正确的是( )
的命名正确的是( )| A. | 2,3-二乙基-2-丁烯 | B. | 2,3-二乙基-3-丁烯 | ||
| C. | 3-甲基-2-乙基-2-戊烯 | D. | 3,4-二甲基-3-己烯 |
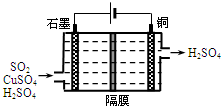 一种以铜作催化剂脱硫有如下两个过程:
一种以铜作催化剂脱硫有如下两个过程: