题目内容
20.用酸碱滴定法测定工业硫酸的含量,称取硫酸试样2.0000g,配成250mL的溶液、移取25mL该溶液,以甲基橙为指示剂,用浓度为0.1233mol/L的NaOH标准溶液滴定,到终点时消耗NaOH溶液31.42mL,试计算该工业硫酸的质量分数.分析 发生2NaOH+H2SO4=Na2SO4+2H2O,消耗NaOH为0.123mol/L×0.03142L=0.0039mol,结合反应计算.
解答 解:消耗NaOH为0.123mol/L×0.03142L=0.00386mol,由2NaOH+H2SO4=Na2SO4+2H2O可知硫酸的物质的量为0.00386mol×$\frac{1}{2}$=0.0019mol,
取硫酸试样2.0000g,配成250mL的溶液、移取25mL该溶液,则硫酸的质量分数为$\frac{0.0019mol×\frac{250}{25}×98g/mol}{2.0g}$×100%=93.1%,
答:该工业硫酸的质量分数为93.1%.
点评 本题考查中和滴定及计算,为高频考点,把握发生的反应及物质的量关系为解答本题的关键,侧重分析与计算的考查,注意酸碱物质的量关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.电对Zn2+/Zn加入氨水后,其电极电势将( )
| A. | 减小 | B. | 增大 | C. | 不变 | D. | 无法确定 |
9.将标准状况下3360mL SO2气体通入100mL2mol/L的NaOH溶液中充分反应,所得溶液的溶质组成是( )
| A. | Na2SO3 | B. | NaHSO3 | C. | Na2SO3和NaHSO3 | D. | NaOH和Na2SO3 |
10.将下列物质分别加入到溴水中,溴单质的物质的量减少的是( )
| A. | CCl4 | B. | KI | C. | KCl | D. | Cl2 |
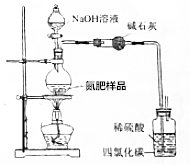 用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).
用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).