题目内容
在四个相同的容器中,不同的温度下(其他条件相同)进行合成R:[P(g)+3Q(g)?2R(g)△H<0的反应,根据下列在未达到平衡时的相同时间内测得的结果判断,达到平衡时Q的转化率最高的是( )
| A、v(R)=0.1mol?L-1?min-1 |
| B、v(P)=0.3mol?L-1?min-1 |
| C、v(Q)=0.3mol?L-1?min-1 |
| D、v(Q)=0.6mol?L-1?min-1 |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:计算容器中不同温度下Q的反应速率比较,依据反应速率之比等于化学方程式系数之比换算成Q的速率,速率越大转化率越大.
解答:
解:P(g)+3Q(g)?2R(g),反应速率之比等于系数之比,
A、v(Q)=
v(R)=
×0.1mol?L-1?min-1 =0.15mol?L-1?min-1 ;
B、v(Q)=3v(P)=3×0.3mol?L-1?min-1 =0.9mol?L-1?min-1 ;
C、v(Q)=0.3mol?L-1?min-1;
D、v(Q)=0.6mol?L-1?min-1;
综上所述B反应速率大达到平衡时Q的转化率最高,
故选B.
A、v(Q)=
| 3 |
| 2 |
| 3 |
| 2 |
B、v(Q)=3v(P)=3×0.3mol?L-1?min-1 =0.9mol?L-1?min-1 ;
C、v(Q)=0.3mol?L-1?min-1;
D、v(Q)=0.6mol?L-1?min-1;
综上所述B反应速率大达到平衡时Q的转化率最高,
故选B.
点评:本题考查了化学反应速率快慢的比较,难度不大,常用归一法与比值法判断,要注意单位是否相同.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
已知金属钠投入水中发生剧烈反应,并有氢气生成.装运金属钠的包装箱应贴的图标是( )
A、 腐蚀品 |
B、 爆炸品 |
C、 遇湿易燃品 |
D、 氧化剂 |
100℃下,某反应达到平衡,平衡常数K=
.恒容时,升高温度,NO浓度减小.下列说法正确的是( )
| c(NO)?c(SO3) |
| c(NO2)?c(SO2) |
| A、该反应的焓变为正值 |
| B、恒温下减小压强,反应体系的颜色加深 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为NO2+SO?NO+SO3 |
下列关于化学平衡状态的说法中正确的是( )
| A、改变外界条件不能改变化学平衡状态 |
| B、当某反应在一定条件下反应物转化率保持不变时即达到了化学平衡状态 |
| C、当某反应体系中气体的压强不再改变时,该反应一定达到平衡状态 |
| D、当某反应达到平衡状态时,反应物和生成物的浓度一定相等 |
下列离子方程式书写正确的是( )
| A、NaClO溶液中通入少量的SO2气体:2ClO-+SO2+H2O═SO32-+2HClO | ||||
| B、往氨水中滴加FeCl3溶液:Fe3++3OH-═Fe(OH)3↓ | ||||
| C、向Ca(HCO3)2溶液中滴加过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | ||||
D、等体积等物质的量浓度的NH4HCO3与Ba(OH)2溶液混合后加热:NH4++OH-
|
锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池. 某种锂电池的总反应式是Li+MnO2=LiMnO2.下列说法正确的是( )
| A、Li是负极,电极反应为Li-e-=Li+ |
| B、Li是正极,电极反应为Li+e-=Li- |
| C、MnO2是负极,电极反应为MnO2+e-=MnO2- |
| D、锂电池工作过程:化学能转化为电能 |
将Al片和Cu片用导线相连,一组插入浓盐酸中,一组插入稀氢氧化钠溶液中,分别形成原电池,则在这两原电池中,正极分别为( )
| A、Cu片、Cu片 |
| B、Cu片、Al片 |
| C、Al片、Al片 |
| D、Al片、Cu片 |
 已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.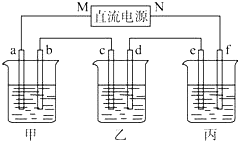 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaCl溶液、足量的AgNO3溶液和 K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaCl溶液、足量的AgNO3溶液和 K2SO4溶液,电极均为石墨电极.