题目内容
 已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.(1)W在周期表中的位置:
(2)在一定条件下,容积为1L密闭容器中加入1.2molX2和0.4molY2,发生如下反应:
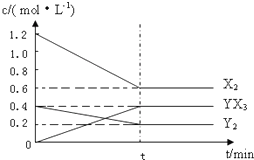
3X2(g)+Y2(g)?2YX3(g)△H反应各物质的量浓度随时间变化如下:
①计算该温度下此反应的平衡常数K=
②若升高温度平衡常数K减小,则△H
③改变下列条件,能使该平衡向正反应方向移动且平衡常数不变的是
a.增大压强 b.降低温度 c.使用催化剂 d.增大反应物的浓度
(3)常见液态化合物X2Z2的稀溶液易被催化分解,可使用的催化剂为
a.MnO2b.FeCl3c.Na2SO3d.KMnO4
(4)A是四种元素中三种元素组成的电解质,溶液呈碱性,将常温下0.1mol?L-1的A溶液稀释至原体积的10倍后溶液的pH=12,则A的电子式为
(5)以X2为燃料可制成燃料电池.已知:2X2(g)+Z2(g)=2X2Z(l)△H=-572KJ?mol-1
该燃料电池释放228.8KJ电能时,生成1mol液态X2Z,该电池的能量转化率为
考点:位置结构性质的相互关系应用,常见化学电源的种类及其工作原理,物质的量或浓度随时间的变化曲线
专题:元素周期律与元素周期表专题,化学平衡专题,电化学专题
分析:短周期主族元素X、Y、Z、W,原子序数依次增大,X和Z可形成X2Z,X2Z2两种化合物,则X为H元素,Z为O元素,X和Y的原子序数之和等于Z的原子序数,设Y的原子序数为x,则1+x=8,x=7,即Y为N元素,又X、Y、Z、W都是短周期主族元素,且原子序数依次增大,W是短周期主族元素中半径最大的元素,则W为Na元素,以此解答题中各小问:
(1)W为Na元素,原子序数为11,在元素周期表中第三周期第ⅠA族;
(2)①反应3X2(g)+Y2(g)?2YX3(g)的平衡常数k=
,由图可知,平衡时,X2、Y2、YX3的物质的量浓度分别为0.6mol/L、0.2mol/L、0.4mol/L,代入平衡常数k计算;②若升高温度平衡常数K减小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,据此判断;③反应3X2(g)+Y2(g)?2YX3(g)正反应是一个气体体积减小的放热反应,使用催化剂平衡不移动,平衡常数只受温度影响,据此回答;
(3)常见液态化合物H2O2的稀溶液易被催化分解,可使用的催化剂由课本知识可知选ab;
(4)A是四种元素中三种元素组成的电解质,溶液呈碱性,A可能是NaOH或NaNO2,将常温下0.1mol?L-1的A溶液稀释至原体积的10倍后溶液的pH=12,说明A是强碱,为NaOH,据此写A的电子式
(5)电池的能量转化率=
×100%.
(1)W为Na元素,原子序数为11,在元素周期表中第三周期第ⅠA族;
(2)①反应3X2(g)+Y2(g)?2YX3(g)的平衡常数k=
| c2(YX3) |
| c3(X2)?c(Y2) |
(3)常见液态化合物H2O2的稀溶液易被催化分解,可使用的催化剂由课本知识可知选ab;
(4)A是四种元素中三种元素组成的电解质,溶液呈碱性,A可能是NaOH或NaNO2,将常温下0.1mol?L-1的A溶液稀释至原体积的10倍后溶液的pH=12,说明A是强碱,为NaOH,据此写A的电子式
(5)电池的能量转化率=
| 实际产生能量 |
| 理论产生能量 |
解答:
解:短周期主族元素X、Y、Z、W,原子序数依次增大,X和Z可形成X2Z,X2Z2两种化合物,则X为H元素,Z为O元素,X和Y的原子序数之和等于Z的原子序数,设Y的原子序数为x,则1+x=8,x=7,即Y为N元素,又X、Y、Z、W都是短周期主族元素,且原子序数依次增大,W是短周期主族元素中半径最大的元素,则W为Na元素,
(1)W为Na元素,原子序数为11,在元素周期表中第三周期第ⅠA族,故答案为:第三周期第ⅠA族;
(2)①反应3X2(g)+Y2(g)?2YX3(g)的平衡常数k=
,由图可知,平衡时,X2、Y2、YX3的物质的量浓度分别为0.6mol/L、0.2mol/L、0.4mol/L,平衡常数k=
=
,故答案为:
;
②若升高温度平衡常数K减小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,则逆反应为吸热反应,正反应为放热反应,△H<0,故答案为:<;
③反应3X2(g)+Y2(g)?2YX3(g)正反应是一个气体体积减小的放热反应,且平衡常数只受温度影响,a.增大压强平衡向气体体积减小方向移动,即正反应方向,且平衡常数不变,故选a; b.降低温度,平衡常数改变,故b不符合题意; c.使用催化剂平衡不移动故c不符合题意;d.增大反应物的浓度平衡向正反应方向移动且平衡常数不变,故选d;故答案为:ad;
(3)常见液态化合物H2O2的稀溶液易被催化分解,可使用的催化剂由课本知识可知选ab,故答案为:ab;
(4)A是四种元素中三种元素组成的电解质,溶液呈碱性,A可能是NaOH或NaNO2,将常温下0.1mol?L-1的A溶液稀释至原体积的10倍后溶液的pH=12,说明A是强碱,为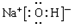 ,故答案为:
,故答案为: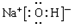 ;
;
(5)已知:2H2(g)+O2(g)=2H2O(l)△H=-572KJ?mol-1,以H2为燃料可制成燃料电池,该燃料电池释放228.8KJ电能时,生成1mol液态H2O,则电池的能量转化率=
×100%=
×100%=80%,故答案为:80%.
(1)W为Na元素,原子序数为11,在元素周期表中第三周期第ⅠA族,故答案为:第三周期第ⅠA族;
(2)①反应3X2(g)+Y2(g)?2YX3(g)的平衡常数k=
| c2(YX3) |
| c3(X2)?c(Y2) |
| 0.42 |
| 0.63×0.2 |
| 100 |
| 27 |
| 100 |
| 27 |
②若升高温度平衡常数K减小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,则逆反应为吸热反应,正反应为放热反应,△H<0,故答案为:<;
③反应3X2(g)+Y2(g)?2YX3(g)正反应是一个气体体积减小的放热反应,且平衡常数只受温度影响,a.增大压强平衡向气体体积减小方向移动,即正反应方向,且平衡常数不变,故选a; b.降低温度,平衡常数改变,故b不符合题意; c.使用催化剂平衡不移动故c不符合题意;d.增大反应物的浓度平衡向正反应方向移动且平衡常数不变,故选d;故答案为:ad;
(3)常见液态化合物H2O2的稀溶液易被催化分解,可使用的催化剂由课本知识可知选ab,故答案为:ab;
(4)A是四种元素中三种元素组成的电解质,溶液呈碱性,A可能是NaOH或NaNO2,将常温下0.1mol?L-1的A溶液稀释至原体积的10倍后溶液的pH=12,说明A是强碱,为
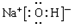 ,故答案为:
,故答案为: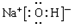 ;
;(5)已知:2H2(g)+O2(g)=2H2O(l)△H=-572KJ?mol-1,以H2为燃料可制成燃料电池,该燃料电池释放228.8KJ电能时,生成1mol液态H2O,则电池的能量转化率=
| 实际产生能量 |
| 理论产生能量 |
| 228.8 | ||
|
点评:本题考查较为综合,涉及元素的推断、化学平衡图象问题、平衡有关计算、平衡常数、外界条件对平衡移动影响、催化剂选择、电子式的书写、盐类的水解以及化学反应与能量等问题,题目具有一定难度,本题正确推断元素的种类是做题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组离子,能在pH=1的无色透明溶液中大量共存的是( )
| A、Na+、NH4+、Cl-、SO42- |
| B、Na+、K+、HCO3-、NO3- |
| C、Na+、Cu2+、Cl-、NO3- |
| D、Mg2+、Na+、H2PO4-、SO42- |
在四个相同的容器中,不同的温度下(其他条件相同)进行合成R:[P(g)+3Q(g)?2R(g)△H<0的反应,根据下列在未达到平衡时的相同时间内测得的结果判断,达到平衡时Q的转化率最高的是( )
| A、v(R)=0.1mol?L-1?min-1 |
| B、v(P)=0.3mol?L-1?min-1 |
| C、v(Q)=0.3mol?L-1?min-1 |
| D、v(Q)=0.6mol?L-1?min-1 |
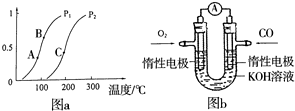 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.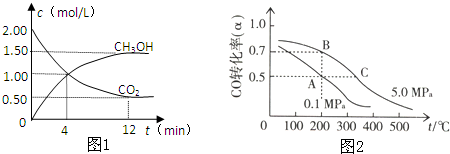

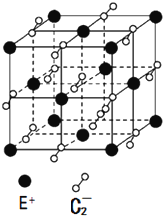 A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.
A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增.已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题.