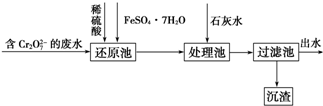
题目内容
14.由氢气和氧气反应生成1mol水蒸气,放出241.8kJ热量(25℃、101kPa下测得)①写出该反应的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
②若1mol水蒸气转化为液态水放热45kJ,则反应H2(g)+$\frac{1}{2}$O2(g)═H2O( l )的△H=-286.8kJ/mol.氢气的燃烧热为△H=-286.8kJ/mol.
分析 ①根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式;
②若1mol水蒸气转化为液态水放热45kJ,即H2O(g)=H2O(l)△H=-45kJ/mol,
根据盖斯定律计算生成液态水的反应热;
1mol氢气完全燃烧生成液态水所放出的热量为其燃烧热.
解答 解:①:氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol;
②若1mol水蒸气转化为液态水放热45kJ,即H2O(g)=H2O(l)△H=-45kJ/mol,
i.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
ii.H2O(g)=H2O(l)△H=-45kJ/mol
i+ii得H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286.8kJ/mol
1mol氢气完全燃烧生成液态水所放出的热量为其燃烧热,所以其燃烧热为-286.8kJ/mol,
故答案为:-286.8;-286.8.
点评 本题考查反应热的有关计算,为高频考点,侧重考查学生分析计算能力,明确基本概念、热化学方程式书写规则、盖斯定律是解本题关键,熟练掌握盖斯定律并灵活运用,题目难度不大.

练习册系列答案
相关题目
4.液氧是航天活动一种重要氧化剂,常与液氢或煤油等配合使用,以下说法错误的是( )
| A. | 工业通过分馏液态空气制备液氧 | |
| B. | 液氧不可燃,铁路旅客可以随身携带 | |
| C. | 液氧与液氢搭配做火箭推进剂的优点之一是清洁环保 | |
| D. | 沥青若长时间浸入液氧可能会发生爆炸 |
5.对化学反应的速率和限度的叙述正确的是( )
| A. | 增加某一反应物的用量一定能够加快该反应的速率 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 化学反应达到限度时,正逆反应速率相等 | |
| D. | 化学反应进行的时间越长该反应的限度越大 |
2.短周期主族元素X、Y、Z、W原子序数依次增大,X的质子数与电子层数相同,Y、Z同周期且相邻,Z的最外层电子数是其内层电子数的3倍,元素W在地壳中的含量仅次于氧.下列说法正确的是( )
| A. | 原子最外层电子数由多到少的顺序:Z>Y>W>X | |
| B. | X、Y、Z三种元素形成的化合物中只有共价键 | |
| C. | 简单气态氢化物的热稳定性:Y>Z | |
| D. | 最高价氧化物对应水化物的酸性:W>Y |
19.下列有关物质的性质或应用均正确的是( )
| A. | 二氧化硅为酸性氧化物,可用于制做计算机芯片 | |
| B. | 铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 | |
| D. | 浓硫酸具有脱水性,可用于干燥NH3、SO2等 |
6.电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法不正确的是( )
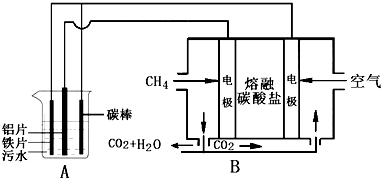

| A. | 装置B中通CH4一极电极反应为:CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 装置B中CO32-向CH4一极移动 | |
| C. | A中阳极相关反应有:Fe-2e-═Fe2+ 2H2O-4e-═4H++O2↑ 12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+ | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
3.下列有关的说法正确的是( )
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| C. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
4.下列实验方案适用于在实验室制取所需SO2的是( )
| A. | Na2SO3溶液与HNO3 | B. | Na2SO3固体与浓硫酸 | ||
| C. | 固体硫在纯氧中燃烧 | D. | 碳与热浓H2SO4 |