题目内容
在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)达到平衡后,保持温度不变,将气体体积缩小到原来的
,当达到新平衡时,C的浓度为原来的1.9倍.下列说法中正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、平衡向逆反应方向移动 |
| C、A的转化率增大 |
| D、C的体积分数增加 |
考点:化学平衡的计算
专题:
分析:平衡后将气体体积缩小到原来的一半,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,但此时C的浓度为原来的1.9倍,说明增大压强平衡向逆反应方向移动,逆向是气体体积减小的反应,根据平衡移动原理分析.
解答:
解:平衡后将气体体积缩小到原来的一半,压强增大,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,但此时C的浓度为原来的1.9倍,说明增大压强平衡向逆反应方向移动,
A、增大压强平衡向逆反应方向移动,增大压强平衡向体积减小的方向移动,则有:m+n<p,故A错误;
B、由上述分析可知,增大压强平衡向逆反应方向移动,故B正确;
C、增大压强平衡向逆反应方向移动,则反应物的转化率降低,故A的转化率降低,故C错误;
D、平衡向逆反应移动,生成物的体积百分含量降低,即C的体积分数降低,故D错误.
故选:B.
A、增大压强平衡向逆反应方向移动,增大压强平衡向体积减小的方向移动,则有:m+n<p,故A错误;
B、由上述分析可知,增大压强平衡向逆反应方向移动,故B正确;
C、增大压强平衡向逆反应方向移动,则反应物的转化率降低,故A的转化率降低,故C错误;
D、平衡向逆反应移动,生成物的体积百分含量降低,即C的体积分数降低,故D错误.
故选:B.
点评:本题考查化学平衡移动的影响,题目难度不大,本题注意用假定法判断,如果平衡不移动,则达到平衡时C的浓度为原来的2倍,根据实际C的浓度,判断平衡移动.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
今有一混合物的水溶液,可能大量含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下针对原溶液的推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下针对原溶液的推测正确的是( )
| A、Cl-一定不存在 |
| B、K+一定存在 |
| C、Mg2+一定存在 |
| D、Ba2+可能存在 |
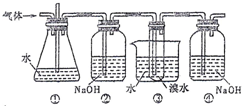 如图是用实验室制得的乙烯(C2H5OH
如图是用实验室制得的乙烯(C2H5OH | 浓硫酸 |
| 170℃ |
| A、装置①和装置③中都盛有水,其作用相同 |
| B、装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C、产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出 |
| D、制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |
一定条件下将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2
2NH3.下列关于该反应的说法正确的是( )
| 高温高压 |
| 催化剂 |
| A、最终可生成0.2mol NH3 |
| B、使用催化剂不影响反应速率 |
| C、升高温度反应速率增大 |
| D、增大压强反应速率减小 |
某溶液中含有SO42ˉ、OHˉ、Na+,下列离子中能够与其大量共存的是( )
| A、NH4+ |
| B、Ba2+ |
| C、CO32ˉ |
| D、HCO3ˉ |
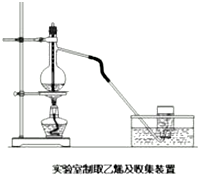 实验室常用下面装置制备乙稀,请回答下列问题:
实验室常用下面装置制备乙稀,请回答下列问题:

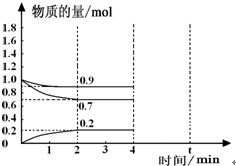 工业上合成合成氨的热化学方程式如下:
工业上合成合成氨的热化学方程式如下: