题目内容
7.利用酸性含锰废水(主要锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料碳酸锰(Mn)纯净的氯化铜晶体(CuCl2•2H2O).工业流程如下: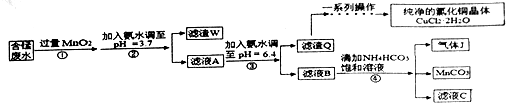
已知某些物质完全沉淀的pH值如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 沉淀完全的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
(2)过程②中,所得滤渣W的成分是Fe(OH)3和过量的MnO2.
(3)过程③中,调pH=6.4目的是使Cu2+ 完全沉淀为Cu(OH)2.
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)将滤渣Q溶解在过量的盐酸中,经过加热浓缩,降温结晶,过滤、洗涤、低温烘干,即可获得纯净的氯化钠晶体(CuCl2•2H2O).
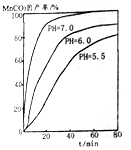
(6)过程④中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如图所示,据图中信息,你选择的最佳pH是7.0;理由是pH等于7.0时反应速率最快,且MnCO3产率最高.
(7)从滤液C可得到的副产品是NH4Cl(填化学式).
分析 酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)加过量MnO2,将Fe2+氧化为Fe3+,加氨水调节pH,Fe3+转化为Fe(OH)3沉淀,过滤,滤渣为Fe(OH)3和过量的MnO2,滤液A含有Mn2+、Cl-、H+、Cu2+,加氨水调节pH=6.4,则Cu2+转化为Cu(OH)2沉淀,过滤,滤渣为Cu(OH)2沉淀,滤液B含有Mn2+、Cl-,加碳酸氢铵反应生成二氧化碳气体、碳酸锰、氯化铵、水.
(1)MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,自身被还原成Mn2+,根据得失电子守恒、电荷守恒、原子守恒书写离子方程式;
(2)根据流程分析判断;
(3)调pH=6.4,除去溶液中的铜离子;
(4)滤液B含有Mn2+、Cl-,加碳酸氢铵反应生成二氧化碳气体、碳酸锰、氯化铵、水;
(5)从溶液中提取溶质,要经过加热浓缩,降温结晶,过滤、洗涤、低温烘干;
(6)根据沉锰的图象可知,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果;
(7)得到的滤液中还有大量的铵根离子和氯离子没有反应,据此判断副产品.
解答 解:(1)过程①中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(2)根据流程分析可知,所得滤渣W的成分是Fe(OH)3和过量的MnO2;
故答案为:Fe(OH)3和过量的MnO2;
(3)调pH=6.4,除去溶液中的铜离子,使Cu2+ 完全沉淀为Cu(OH)2;
故答案为:使Cu2+ 完全沉淀为Cu(OH)2;
(4)滤液B含有Mn2+、Cl-,加碳酸氢铵反应生成二氧化碳气体、碳酸锰、氯化铵、水,其反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(5)从溶液中提取溶质,要经过加热浓缩,降温结晶,过滤、洗涤、低温烘干;
故答案为:加热浓缩,降温结晶;
(6)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:7.0;pH等于7.0时反应速率最快,且MnCO3的产率最高;
(7)得到的滤液中还有大量的铵根离子和氯离子没有反应,因此可以制的副产品为:NH4Cl,
故答案为:NH4Cl.
点评 本题通过碳酸锰的制备,考查了物质制备实验方案的设计方法,题目难度中等,明确制备流程及相应的反应原理为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.

| A. | 铝片保存时可不密闭保存 | |
| B. | 金属钠保存在石蜡油或煤油中 | |
| C. | 氢氧化钠溶液盛装在用玻璃塞的试剂瓶中 | |
| D. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 |
| A. | 铝壶可存放食醋 | B. | 乙烯可催熟水果 | C. | 硅胶可作干燥剂 | D. | 氯气可做消毒剂 |
| A. | 原子半径大小顺序为:M>W>Z>Y>X | |
| B. | X、Y、Z、W四种元索都属于非金属元素,它们之间只能形成共价化合物 | |
| C. | Y、Z、W、M四种元素与X元素分别形成的最简单化合物的沸点依次升高 | |
| D. | X、M均可与W形成可用于自来水杀菌消毒的强氧化性化合物 |
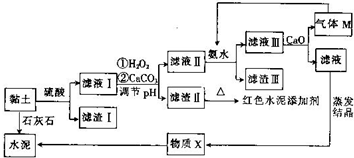
已知:黏土的主要成分为2CaO•3Al2O3•FeO•Fe2O3•10SiO2•nH2O.部分难溶物开始沉淀时和完全沉淀时的pH如表所示.
| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
(2)向滤液Ⅰ中加入H2O2的作用是将滤液中的Fe2+氧化为Fe3+;用CaCO3调节溶液pH约为3.3,其目的是使Fe3+完全转化为Fe(OH)3沉淀而除去.
(3)红色水泥添加剂的主要成分是Fe2O3.
(4)物质X的化学式为CaSO4•2H2O.
(5)气体M的电子式为
 ;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).(6)氮化铝广泛用于电子陶瓷等工业领域,以滤渣Ⅲ、碳及氮气为原料可制备氮化铝,用化学方程式表示制备过程:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
| A. | 用炭炽铁,炭是还原剂 | B. | 炽铁用炭,煤炭占17% | ||
| C. | 火墨燃烧温度比煤高 | D. | 炽铁不能用炊炭 |
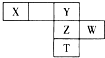 如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )
如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )| A. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| B. | T的最高价氧化物对应的水化物酸性比Z的强 | |
| C. | Y的氢化物沸点高于Z的氢化物,因为H-Y键的键能高于H-Z键 | |
| D. | XY2、XZ2、XW4的化学键类型相同、晶体类型也相同 |
| A. | 发生爆炸的天津滨海仓库存放的电石、氰化钠和硝酸铵等危险化学品均属于电解质 | |
| B. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| C. | 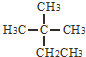 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 的系统命名为:2-甲基-2-乙基丙烷,其一氯代物有5种 | |
| D. | 1mol化合物(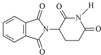 )跟足量NaOH溶液反应最多耗4molNaOH )跟足量NaOH溶液反应最多耗4molNaOH |
①
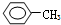
②
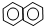
③
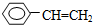
④C2H4
⑤CH2=CH-CH=CH2
⑥C3H6
⑦
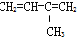
⑧
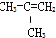
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ⑥和⑧ |