题目内容
17.实验室下列物质的保存方法中不正确的是( )| A. | 铝片保存时可不密闭保存 | |
| B. | 金属钠保存在石蜡油或煤油中 | |
| C. | 氢氧化钠溶液盛装在用玻璃塞的试剂瓶中 | |
| D. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 |
分析 A.铝可以在空气中保存;
B.少量的金属钠保存在煤油中;
C.玻璃的成分是二氧化硅;
D.硫酸亚铁易被氧化为三价铁离子.
解答 解:A.铝片在空气中表面会形成致密的氧化膜,可以放在不密封的容器里,故A正确;
B.金属钠非常活泼,且密度比较小,与水、氧气等反应,故少量的钠保存在煤油中,故B正确;
C.氢氧化钠与玻璃塞中的二氧化硅发生反应,生成能粘合玻璃的硅酸钠,导致塞子打不开,故C错误;
D.硫酸亚铁易被氧化为三价铁离子,可以加入少量的铁粉,防止亚铁离子被氧化,故D正确.
故选C.
点评 本题考查了化学试剂的存放,题目难度不大,需要掌握常见试剂的保存方法,关键是掌握试剂的性质,关键化学性质选择保存方法,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
相关题目
3.化学与人类生活密切相关,下列说法正确的是( )
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 可将工业酒精兑水后饮用,因为其中含有甲醇、乙醇,它具有醇香味 |
5.温度一定时,在密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g),达平衡后,若将混合气体的体积压缩到原来的一半.当再次达到平衡时,C的浓度为原来浓度的1.8倍,下列叙述中正确的是( )
| A. | 平衡向逆反应方向移动 | B. | 气体C的体积分数增大 | ||
| C. | m+n>p | D. | 气体A的转化率升高 |
12.下列离子方程式表达正确的是( )
| A. | FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| B. | 将NH3通入H2SO4溶液中:NH3+H+=NH4+ | |
| C. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| D. | H2SO4溶液与Ba(OH)2溶液混合:H++OH-=H2O |
9.下列有关物质结构的说法中,正确的是( )
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |
7.利用酸性含锰废水(主要锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制备高性能磁性材料碳酸锰(Mn)纯净的氯化铜晶体(CuCl2•2H2O).工业流程如下:
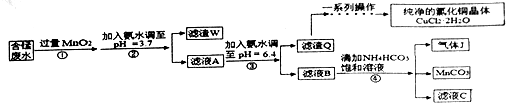
已知某些物质完全沉淀的pH值如下表
回答下列问题:
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
(2)过程②中,所得滤渣W的成分是Fe(OH)3和过量的MnO2.
(3)过程③中,调pH=6.4目的是使Cu2+ 完全沉淀为Cu(OH)2.
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)将滤渣Q溶解在过量的盐酸中,经过加热浓缩,降温结晶,过滤、洗涤、低温烘干,即可获得纯净的氯化钠晶体(CuCl2•2H2O).
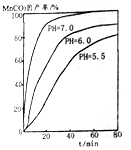
(6)过程④中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如图所示,据图中信息,你选择的最佳pH是7.0;理由是pH等于7.0时反应速率最快,且MnCO3产率最高.
(7)从滤液C可得到的副产品是NH4Cl(填化学式).

已知某些物质完全沉淀的pH值如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 沉淀完全的pH | 9.7 | 3.7 | 6.4 | 10.4 |
(1)过程①中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
(2)过程②中,所得滤渣W的成分是Fe(OH)3和过量的MnO2.
(3)过程③中,调pH=6.4目的是使Cu2+ 完全沉淀为Cu(OH)2.
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(5)将滤渣Q溶解在过量的盐酸中,经过加热浓缩,降温结晶,过滤、洗涤、低温烘干,即可获得纯净的氯化钠晶体(CuCl2•2H2O).
(6)过程④中,298K、c(Mn2+)为1.05mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间关系如图所示,据图中信息,你选择的最佳pH是7.0;理由是pH等于7.0时反应速率最快,且MnCO3产率最高.

(7)从滤液C可得到的副产品是NH4Cl(填化学式).
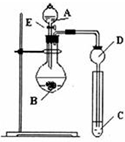 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.