题目内容
11.CO不仅是家用煤气的主要成分,也是重要的化工原料.如图是用某些简单有机物在低温、低压和催化剂存在下合成具有优良性能的装饰性高分子涂料、黏胶剂的基本过程.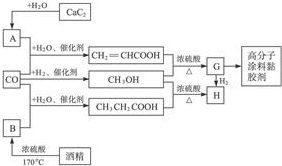
已知CaC2与水反应的化学方程为CaC2+2H2O→Ca(OH)2+HC≡CH↑.回答下列问题:
(1)写出G的结构简式CH2═CHCOOCH3.
(2)写出图中生成CH3OH(甲醇)的化学方程式CO+2H2$\stackrel{催化剂}{→}$CH3OH.写出在浓硫酸作用下生成H的化学方程式CH3OH+CH3CH2COOH$?_{△}^{浓硫酸}$CH3OOCCH2CH3.
(3)指出上述工艺的优点是什么?原料成本低,反应在低温、低压和催化剂条件下进行,能量消耗低,反应过程中没有任何副产品产生,原料利率高.
分析 乙醇在浓硫酸作催化剂、170℃条件下发生消去反应生成B,B为CH2=CH2,丙烯酸和甲醇发生酯化反应生成G,G为CH2=CHCOOCH3,丙酸和甲醇发生酯化反应生成H,H为CH3CH2COOCH3,G和氢气发生加成反应生成H,G发生加聚反应生成高分子化合物,该高分子化合物结构简式为 ,碳化钙和水反应生成乙炔,所以A为HC≡CH,据此分析解答.
,碳化钙和水反应生成乙炔,所以A为HC≡CH,据此分析解答.
解答 解:乙醇在浓硫酸作催化剂、170℃条件下发生消去反应生成B,B为CH2=CH2,丙烯酸和甲醇发生酯化反应生成G,G为CH2=CHCOOCH3,丙酸和甲醇发生酯化反应生成H,H为CH3CH2COOCH3,G和氢气发生加成反应生成H,G发生加聚反应生成高分子化合物,该高分子化合物结构简式为 ,碳化钙和水反应生成乙炔,所以A为HC≡CH,
,碳化钙和水反应生成乙炔,所以A为HC≡CH,
(1)通过以上分析知,G结构简式为CH2═CHCOOCH3,故答案为:CH2═CHCOOCH3;
(2)CO和氢气在催化剂条件下反应生成甲醇,反应方程式为CO+2H2$\stackrel{催化剂}{→}$CH3OH,在浓硫酸作用下,丙酸和甲醇发生酯化反应生成丙酸甲酯,反应方程式为CH3OH+CH3CH2COOH$?_{△}^{浓硫酸}$CH3OOCCH2CH3,
故答案为:CO+2H2$\stackrel{催化剂}{→}$CH3OH;CH3OH+CH3CH2COOH$?_{△}^{浓硫酸}$CH3OOCCH2CH3;
(3)该工艺优点为原料成本低,反应在低温、低压和催化剂条件下进行,能量消耗低,反应过程中没有任何副产品产生,原料利率高,故答案为:原料成本低,反应在低温、低压和催化剂条件下进行,能量消耗低,反应过程中没有任何副产品产生,原料利率高.
点评 本题考查有机物推断,为高频考点,明确官能团及其性质关系是解本题关键,涉及有机物推断、反应方程式的书写,注意反应条件,为易错点.

 优学名师名题系列答案
优学名师名题系列答案①碳酸钠溶液与盐酸
②偏铝酸钠溶液与盐酸
③氢氧化钠溶液与CO2
④硝酸银溶液与氨水
⑤氯化铝溶液与氨水.
| A. | ③⑤ | B. | ①③ | C. | 仅有⑤ | D. | ②④ |
| A. | 元素丙的单质可用于冶炼金属 | B. | 丙与丁形成的化合物能升华 | ||
| C. | 甲与乙形成的化合物溶于水呈酸性 | D. | 简单离子半径:丁>乙>丙 |
| A. | 强酸性 | B. | 吸水性 | C. | 脱水性 | D. | 强氧化性 |
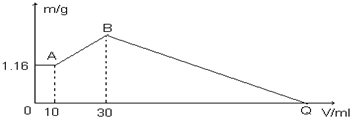
①该温度下,水的离子积常数Kw=10-13.
②该温度下,100mL 0.1mol/L的稀硫酸溶液中由水电离的c(OH-)=5×10-13mol/L.
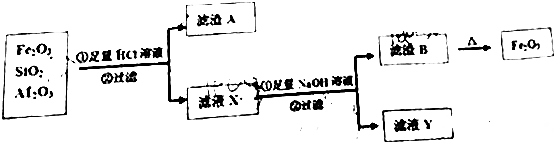
(2)实验室用Na2SO3固体与70%的硫酸反应制取SO2气体时,可用NaOH溶液或Fe2(SO4)3溶液吸收多余的SO2气体.用Fe2(SO4)3溶液吸收多余的SO2气体,写出SO2与Fe2(SO4)3溶液反应的离子方程式SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
(3)用Fe2(SO4)3溶液吸收SO2气体一段时间后,吸收液中一定存在的离子有H+、Fe2+、SO42-和极少量的OH-.某同学认为还可能存在其他离子,并提出假设进行实验探究.
①提出合理假设:
假设1:还存在HSO3-、SO32-;
假设2:还存在Fe3+;
假设3:HSO3-、SO32-、Fe3+都不存在
②设计实验方案
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,加稀硫酸酸化,然后再滴入几滴品红溶液; | 现象:品红不褪色 结论:假设1不成立; |
| 步骤2:另取少量吸收液于试管中, 滴入几滴KSCN溶液. | 现象:溶液变红 结论:假设2成立. |
 .
.