题目内容
13.下列除杂试剂的选择或除杂操作不正确的是( )| 括号内为杂项 | 除杂试剂 | 除杂操作 | |
| A | Na2O2(Na2O) | O2 | 在纯氧中加热 |
| B | Na2CO3(NaHCO3) | CO2 | 通入过量的CO2 |
| C | FeCl(FeCl2) | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4) | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氧化钠与氧气反应生成过氧化钠;
B.碳酸钠与二氧化碳反应生成碳酸氢钠;
C.氯化亚铁与氯气反应生成氯化铁;
D.Fe与硫酸铜反应生成硫酸亚铁和Cu.
解答 解:A.氧化钠与氧气反应生成过氧化钠,则在纯氧中加热可除杂,故A正确;
B.碳酸钠与二氧化碳反应生成碳酸氢钠,将原物质除去,不能除杂,固体混合物时加热可除杂,溶液中加适量NaOH可除杂,故B错误;
C.氯化亚铁与氯气反应生成氯化铁,则通入过量的Cl2可除杂,故C正确;
D.Fe与硫酸铜反应生成硫酸亚铁和Cu,则加入过量的Fe粉,充分反应后过滤可除杂,故D正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
8. 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
(1)体系中发生反应的化学方程式是2X+2Y?2Z+W;
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
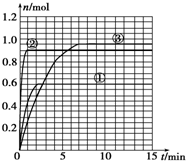
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z和W,它们的物质的量随时间的变化如下表所示.| t/min | X/mol | Y/mol | Z/mol | W/mol |
| 0 | 2.00 | 1.00 | 0.00 | 0.00 |
| 1 | 1.80 | 0.80 | 0.20 | 0.10 |
| 3 | 1.50 | 0.50 | 0.50 | 0.25 |
| 5 | 1.30 | 0.30 | 0.70 | 0.35 |
| 9 | 1.10 | 0.10 | 0.90 | 0.45 |
| 10 | 1.10 | 0.10 | 0.90 | 0.45 |
| 14 | 1.10 | 0.10 | 0.90 | 0.45 |
(2)列式计算该反应在0~3min时间内产物W的平均反应速率:0.042 mol/(L•min);
(3)该反应达到平衡时反应物Y的转化率α等于90%;
(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如图所示)则曲线①、②、③所对应改变的实验条件分别是:①升高温度;②加入催化剂;③增大压强.
18.葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6$\stackrel{酵母}{→}$2CH3CH2OH+2CO2↑).
Ⅰ、已知:实验室制乙烯原理为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略).

实验操作和现象:
(1)溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(2)分析,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,使B中溶液褪色反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br;
②乙根据现象认为实验中产生的SO2和H2O,使B中有色物质反应褪色.
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色.
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)

现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色.
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是NaOH溶液;乙设计的实验D中盛放的试剂是浓硫酸,装置连接顺序为(d)cabe(f).
b.能说明确实是SO2使E中溶液褪色的实验是加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2.
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.由此可得出的干燥的SO2 不能使Br2 的四氯化碳溶液褪色
Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂.
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如右图所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
Ⅰ、已知:实验室制乙烯原理为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略).

实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(2)分析,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,使B中溶液褪色反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br;
②乙根据现象认为实验中产生的SO2和H2O,使B中有色物质反应褪色.
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色.
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)

现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色.
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是NaOH溶液;乙设计的实验D中盛放的试剂是浓硫酸,装置连接顺序为(d)cabe(f).
b.能说明确实是SO2使E中溶液褪色的实验是加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2.
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.由此可得出的干燥的SO2 不能使Br2 的四氯化碳溶液褪色

Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂.
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如右图所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
5.向含 l mol HCl和l mol MgSO4的混合溶液中加入1mol•L-1 Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )
| A. |  | B. | 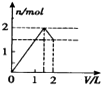 | C. | 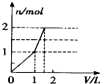 | D. | 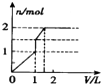 |
2.下图中能组成原电池产生电流的是( )
| A. |  | B. |  | C. |  | D. |  |
3.下列有关工业生产的叙述中错误的是( )
| A. | 电解氯化钠溶液制金属钠 | B. | 石灰石是炼铁和制玻璃的原料之一 | ||
| C. | 氯气通入石灰乳中制漂白粉 | D. | 工业炼铁的主要设备高炉 |
 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.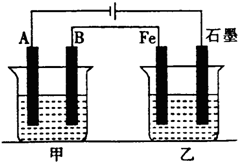 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答: