题目内容
5.向含 l mol HCl和l mol MgSO4的混合溶液中加入1mol•L-1 Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )| A. |  | B. | 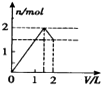 | C. | 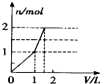 | D. | 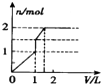 |
分析 HCl和MgSO4溶液存在H+、Mg2+和SO42-离子,加入Ba(OH)2溶液,首先发生Ba2++SO42-=BaSO4↓、H++OH-=H2O,然后发生Mg2++2OH-=Mg(OH)2↓,结合物质的量的关系分析.
解答 解:向含 l mol HCl和l mol MgSO4的混合溶液中加入1mol•L-1 Ba(OH)2溶液,首先发生Ba2++SO42-=BaSO4↓、H++OH-=H2O,当加入0.5L氢氧化钡时,盐酸全部反应,生成0.5mol硫酸钡沉淀,继续加氢氧化钡,发生Ba2++SO42-=BaSO4↓、Mg2++2OH-=Mg(OH)2↓,当加入氢氧化钡体积为1L时,硫酸根离子完全反应,生成0.5mol硫酸钡沉淀和0.5mol氢氧化镁沉淀,再加0.5L氢氧化钡时,镁离子完全沉淀,又生成0.5mol氢氧化镁沉淀,所以需要氢氧化钡共1.5L,图象A符合.
故选A.
点评 本题考查离子反应问题,题目难度中等,注意把握离子反应的先后顺序为解答该题的关键,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
16.分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述不正确的是( )


| A. | 分子中含有4种官能团 | |
| B. | 分子式为C10H8O6 | |
| C. | 1mol分枝酸最多可与2mol乙醇发生酯化反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
13.下列除杂试剂的选择或除杂操作不正确的是( )
| 括号内为杂项 | 除杂试剂 | 除杂操作 | |
| A | Na2O2(Na2O) | O2 | 在纯氧中加热 |
| B | Na2CO3(NaHCO3) | CO2 | 通入过量的CO2 |
| C | FeCl(FeCl2) | Cl2 | 通入过量的Cl2 |
| D | FeSO4(CuSO4) | Fe | 加入过量的Fe粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
10.煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题:
(1)上述反应的正反应是放热反应(填“放热”或“吸热”),该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$,.
(2)能判断该反应是否达到化学平衡状态的依据是bc(填序号)
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为C.
A.加压,400~500℃催化剂 B.加压,830~1000℃催化剂
C.常压,400~500℃催化剂D.常压,830~1000℃催化剂
(4)在830℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10min后达到平衡时,CO2的平衡浓度为1.2mol/L,用H2浓度变化来表示的平均反应速率为0.12mol/(L•min),CO的转化率是60%.
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是a(填字母序号)
a.增大CO浓度 b.升高温度
c.将生成物分离出去 d.使用高效催化剂.
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(1)上述反应的正反应是放热反应(填“放热”或“吸热”),该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}O)}$,.
(2)能判断该反应是否达到化学平衡状态的依据是bc(填序号)
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)在实际生产中,该反应的适宜条件为C.
A.加压,400~500℃催化剂 B.加压,830~1000℃催化剂
C.常压,400~500℃催化剂D.常压,830~1000℃催化剂
(4)在830℃时,2L的密闭容器中加入4molCO(g)和6molH2O(g),10min后达到平衡时,CO2的平衡浓度为1.2mol/L,用H2浓度变化来表示的平均反应速率为0.12mol/(L•min),CO的转化率是60%.
(5)为使该反应的反应速率增大且平衡向正反应方向移动的是a(填字母序号)
a.增大CO浓度 b.升高温度
c.将生成物分离出去 d.使用高效催化剂.
17.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
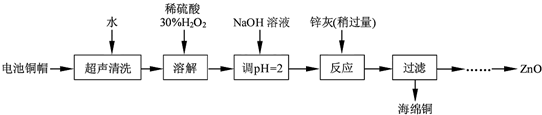
(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
实验中可选用的试剂:30% H2O2、1.0mol•L-1HNO3、1.0mol•L-1 NaOH.
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.

(1)①铜帽溶解时加入H2O2的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).
②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去并半分钟内不恢复.
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会偏高(填“偏高”“偏低”“不变”).
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入30%H2O2,使其充分反应;
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;
③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
14.下列反应中属于消去反应的是( )
| A. | 乙烯使溴水褪色 | B. | 乙醇与浓硫酸共热至170℃ | ||
| C. | 溴乙烷与NaOH水溶液共热 | D. | 在液溴与苯的混合物中撒入铁粉 |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |