题目内容
7.用惰性电极电解下列电解质溶液,有关叙述正确的是( )| A. | 等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大 | |
| B. | NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸 | |
| C. | Na2SO4溶液在电解过程中,阴极区pH值降低 | |
| D. | 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH- |
分析 A.电解NaCl溶液时电解反应方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2 OH-+H2↑+Cl2↑,生成的NaOH能和AlCl3反应,假设NaCl和AlCl3的物质的量都是1mol,4mol氯离子放电后生成2mol氯气,阴极上生成4molOH-,4molOH-和1mol铝离子完全反应生成AlO2-,电解完全后溶液中溶质为偏铝酸钠;
B.电解NaCl溶液时电解反应方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2 OH-+H2↑+Cl2↑,所以析出的物质相当于HCl;
C.Na2SO4溶液在电解过程中,阴极反应式为2H2O+2e-=2 OH-+H2↑,阴极附近溶液呈碱性;
D.电解CuSO4溶液,阳极上氢氧根离子失电子生成氧气.
解答 解:A.电解NaCl溶液时电解反应方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2 OH-+H2↑+Cl2↑,生成的NaOH能和AlCl3反应,假设NaCl和AlCl3的物质的量都是1mol,4mol氯离子放电后生成2mol氯气,阴极上生成4molOH-,4molOH-和1mol铝离子完全反应生成AlO2-,电解完全后溶液中溶质为偏铝酸钠,所以电解前后溶液由弱酸性变为弱碱性,溶液的pH值增大,故A正确;
B.电解NaCl溶液时电解反应方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2 OH-+H2↑+Cl2↑,所以析出的物质相当于HCl,应该通入适量HCl才能使溶液恢复原状,故B错误;
C.Na2SO4溶液在电解过程中,阴极反应式为2H2O+2e-=2 OH-+H2↑,阴极附近溶液呈碱性,溶液的pH升高,故C错误;
D.电解CuSO4溶液,阳极上氢氧根离子失电子生成氧气,电极反应式为4OH--4e-=2H2O+O2↑,故D错误;
故选A.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,明确各个电极上离子放电顺序是解本题关键,注意A电解过程中发生的反应及B中盐酸和HCl的区别,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | c(H+) | B. | Kb(NH3•H2O) | ||
| C. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$ | D. | c(NH4+) |
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9 | 6.7 |
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的PH将Fe3+沉淀除去:你认为用NaClO作氧化剂是否妥当?否(填“是”或“否”),现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有BD(有几个选几个,填代号,下同).
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)①加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的AD.
A.CuO B.NH3•H2O C.NaOH D.Cu(OH)2
②加上述物质调节溶液的PH为3.2~4.7,原因是铁离子沉淀完全时的PH值为3.2,铜离子开始沉淀时的PH值为4.7,除杂时要使铁离子沉淀完全,不能使铜离子产生沉淀
(4)最后能不能直接将溶液蒸发得到CuCl2•2H2O?不能(填“能”或者“不能”).若不能,应该如何操作才能得到CuCl2•2H2O应在氯化氢气氛中浓缩后冷却结晶(若填“能”,此空不用回答)
| A. | 实验室可用排饱和食盐水的方法收集氯气 | |
| B. | 加催化剂,使N2和H2在一定条件下转化为NH3 | |
| C. | 打开汽水瓶,看到有大量的气泡逸出 | |
| D. | Fe(SCN)3溶液中加入6mol/LNaOH溶液后颜色变浅 |
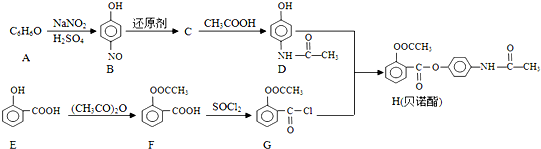
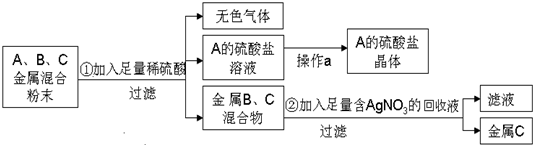
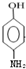 ;
;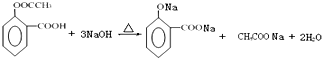 ;
;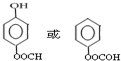 ;
;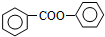 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):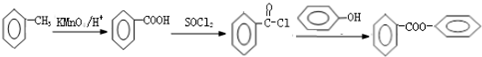 .
.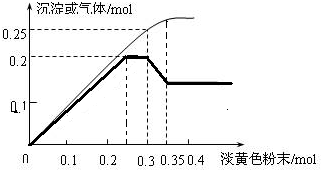 图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:
图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答: