题目内容
3.下列说法不正确的是( )①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎相同
③元素种类由质子数决定,核素种类由质子数和中子数共同决定,元素主要化学性质 由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
| A. | ①②④ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
分析 ①质子数相同的原子一定属于同种元素;
②互为同位素原子,核外电子排布相同,最外层电子数决定化学性质;
③元素是质子数相同的一类原子的总称,原子是由质子和中子决定的,最外层电子数决定了元素的化学性质;
④两种粒子,电子数一样,离子带电,分子、原子不带电,则两种粒子质子数不一定相同,据此判断;
⑤大多数元素都有两种或两种以上的核素,钠元素只有一种核素.
解答 解:①元素的研究对象是原子,质子数相同的粒子不一定属于同种元素,如CH4与H2O,若为原子则属于同种元素,故①错误;
②互为同位素原子,核外电子排布相同,最外层电子数决定化学性质,同位素的化学性质几乎完全相同,物理性质有较大差别,故②正确;
③元素是质子数相同的一类原子的总称,原子是由质子和中子决定的,最外层电子数决定了元素的化学性质,故③正确;
④两种粒子,电子数一样,离子带电,分子、原子不带电,则两种粒子质子数不一定相同,如Na+与Ne电子数相同,但质子数不同属于不同元素,故④正确;
⑤大多数元素都有两种或两种以上的核素,钠元素只有一种核素,故⑤错误;故选D.
点评 本题考查同位素、质量数等基本概念,侧重于基础知识的考查,题目难度不大,注意把握同位素概念的内涵与外延.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
13.草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快.某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究.
实验Ⅰ:在2支试管中分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1mol•L-1KMnO4溶液.记录溶液褪色时间,如表1:
[表1]
实验Ⅱ:另取2支试管分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1mol•L-1 KMnO4溶液.记录溶液褪色时间,如表2:
[表2]
实验Ⅲ:另取3支试管分别加入5mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1mL、2mL稀硫酸溶液,再各加入5滴0.1mol•L-1KMnO4溶液,然后置于温度为65℃的水浴中加热.记录溶液褪色时间,如表3:
[表3]
(1)实验Ⅰ得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率.
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:①②③.
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色从无色变为浅紫红色,且30s不改变.滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度偏大(选填:偏大、偏小、无影响).
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
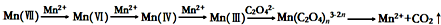
上述实验中,实验Ⅰ可证明这个历程是可信的.
实验Ⅰ:在2支试管中分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1mol•L-1KMnO4溶液.记录溶液褪色时间,如表1:
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
实验Ⅱ:另取2支试管分别加入5mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1mol•L-1 KMnO4溶液.记录溶液褪色时间,如表2:
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
实验Ⅲ:另取3支试管分别加入5mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1mL、2mL稀硫酸溶液,再各加入5滴0.1mol•L-1KMnO4溶液,然后置于温度为65℃的水浴中加热.记录溶液褪色时间,如表3:
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
(1)实验Ⅰ得出的结论是Mn2+(或硫酸锰)在反应中起到催化剂的作用,加快了反应速率.
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:①②③.
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色从无色变为浅紫红色,且30s不改变.滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度偏大(选填:偏大、偏小、无影响).
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
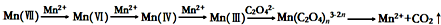
上述实验中,实验Ⅰ可证明这个历程是可信的.
14.有机物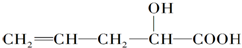 在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中-OH有关的可能反应为( )
在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中-OH有关的可能反应为( )
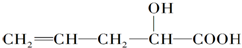 在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中-OH有关的可能反应为( )
在不同条件下至少可能发生以下有机反应:①取代 ②加成 ③消去 ④氧化 ⑤酯化,其中跟其分子结构中-OH有关的可能反应为( )| A. | ①②④⑤ | B. | ①②③⑤ | C. | ②③④⑤ | D. | ①③④⑤ |
12.某化学课外小组为了探究AgNO3溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知Ag2SO4在水中微溶,AgCl在水中难溶)
| 实验步骤 | 向3-4mL 1mol/L AgNO3溶液中滴入1mol/L的Na2SO4溶液至反应完全. |
| 实验现象 | ①产生白色沉淀 |
| 离子方程式 | 2Ag++SO${\;}_{4}^{2-}$=Ag2SO4 |
| 小组讨论交流 | 取上述反应后的清液于试管中滴入适量1mol/L的NaCl 溶液,对于会出现的现象提出了假设 |
| 提出假设 | 假设Ⅰ:反应没有限度 假设Ⅱ:②无现象 |
| 证明假设Ⅱ | 现象③:产生白色沉淀;理由④反应存在限度,溶液中尚有较多Ag+ |
| 离子方程式 | ⑤Ag++Cl-=AgCl↓ |
| 解释 | ⑥加入Cl-产生了大量的白色沉淀,说明Ag++Cl- AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 |
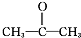 .
.

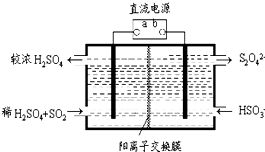 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.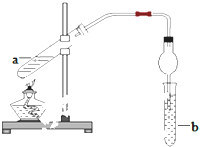 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入5mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.