题目内容
12.用Cu2O可制备环保防污涂料.有一种制备Cu2O的方法是向CuSO4溶液中加入Na2SO3,加热,保持微沸一段时间,过滤得到Cu2O固体.已知:Cu2O+2H+→Cu+Cu2++H2O.下列说法正确的是( )| A. | 反应过程的离子方程式:2Cu2++3SO32-→Cu2O↓+SO42-+2SO2↑ | |
| B. | 反应过程的离子方程式:2Cu2++3SO32-+2H2O→Cu2O↓+SO42-+4H+ | |
| C. | 加入过量Na2SO3有利于控制溶液的pH | |
| D. | 在酸性条件下,若有14.4g Cu2O变质,转移电子0.02mol |
分析 A.反应Cu的化合价从+2降低到+1价,SO32-中S的化合价从+4价升高为+6价,根据原子守恒和电子守恒配平;
B.A.反应Cu的化合价从+2降低到+1价,SO32-中S的化合价从+4价升高为+6价,根据原子守恒和电子守恒配平;
C.Cu2O在酸性条件下会转化为Cu和铜离子;
D.先计算Cu2O的物质的量,再根据Cu2O与电子之间的关系计算.
解答 解:A.反应Cu的化合价从+2降低到+1价,SO32-中S的化合价从+4价升高为+6价,则2Cu2++SO32-+2H2O=Cu2O↓+SO42-+4H+,故A错误;
B.A.反应Cu的化合价从+2降低到+1价,SO32-中S的化合价从+4价升高为+6价,则2Cu2++SO32-+2H2O=Cu2O↓+SO42-+4H+,故B错误;
C.Cu2O在酸性条件下会转化为Cu和铜离子,所以加入过量Na2SO3有利于控制溶液的pH,防止Cu2O与氢离子反应,故C正确;
D.在酸性条件下,Cu2O+2H+=Cu+Cu2++H2O,若有14.4g Cu2O即0.1mol变质,转移电子0.2mol,故D错误.
故选C.
点评 本题考查了氧化还原反应、离子方程式的书写,题目难度不大,注意根据元素化合价的变化分析氧化还原反应,侧重于考查学生的分析能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
20.pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值.如某溶液中某溶液的浓度为1×10-3mlo/L,则该溶液中该溶质的pC=-1g(1×10-3)=3.如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5mlo/L,可认为该离子不存在).下列说法不正确的是( )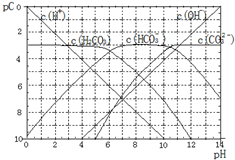

| A. | 某温度下,CO2饱和溶液的浓度是0.05mol•L-1,其中$\frac{1}{5}$的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% | |
| B. | 25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6 | |
| C. | 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO${\;}_{3}^{2-}$)+c(OH-)+c(HCO${\;}_{3}^{-}$) | |
| D. | 25℃时,0.1mol/LNa2CO3中C(HCO${\;}_{3}^{-}$)比0.1mol/LH2CO3中C(HCO${\;}_{3}^{-}$)大 |
7.下列各组物质中,所含电子数相同的是( )
| A. | 0.5mol37Cl2和16g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 20g D2O和10g H2 | D. | 224mL D2和0.1mol N2 |
7.下列各组内物质不论以任何比例混合,只要当混合物的质量一定时,混合物完全燃烧后生成的二氧化碳的量不变的是( )
| A. | 乙炔和苯 | B. | 一氧化碳和氢气 | C. | 乙炔和乙烯 | D. | 苯和乙烯 |
5.下列说法中正确的是( )
| A. | 乙烯、1,3-丁二烯、聚乙烯均能与溴水发生加成反应 | |
| B. | 实验室中要除去乙烷中混有的乙烯气体,可以用通入H2催化加氢的方法 | |
| C. | 沸点由高到低依次为:正戊烷>异戊烷>新戊烷>正丁烷>异丁烷 | |
| D. | 室温光照条件下,可以用CH4与氯气制取纯净的一氯甲烷,该反应属于取代反应 |
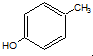 对甲基苯酚与溴水反应
对甲基苯酚与溴水反应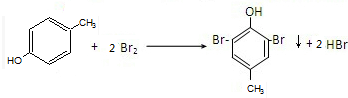
 环已二烯与氯气1,4加成
环已二烯与氯气1,4加成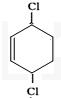
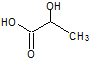 乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$
乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$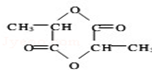 +2H2O
+2H2O .
.