题目内容
13.下列关于氯气的叙述正确的是( )| A. | 钠在氯气中燃烧产生白色烟雾 | |
| B. | 氯气可以与铁反应,因此氯气不能贮藏在钢瓶中 | |
| C. | 纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰 | |
| D. | 氯气可用于漂白,这是氯气的漂白作用 |
分析 A、钠与氯气反应生成氯化钠;
B、干燥的氯气与铁在常温下不反应;
C、氢气可以在氯气中安静的燃烧,会发出苍白色火焰;
D、干燥的氯气不具有漂白性.
解答 解:A、钠与氯气反应生成氯化钠,观察到白烟,故A错误;
B、干燥的氯气与铁在常温下不反应,因此氯气能贮藏在钢瓶中,故B错误;
C、氢气可以在氯气中安静的燃烧,会发出苍白色火焰,瓶口会出现白雾,故C正确;
D、干燥的氯气不具有漂白性,氯气和水之间反应生成的次氯酸具有漂白性,故D错误.
故选C.
点评 本题涉及氯气的性质的考查,注意知识的归纳和整理是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.化学与科技、生活密切相关.下列说法错误的是( )
| A. | 肥皂水、矿泉水及食醋三种溶液的pH依次减小 | |
| B. | 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 | |
| C. | 食品袋中放入盛有硅胶和铁粉的透气小袋,是为了防止食物受潮、氧化变质 | |
| D. | 采用“静电除尘”、“汽车尾气催化净化”等方法可减少“雾霾”的发生 |
1.表为元素周期表的一部分,请回答下列问题:
(1)元素③在元素周期表中的位置是第二周期VA族.
(2)④和⑤两种元素的最高价氧化物对应水化物酸性较弱的是H2SO4(填化学式),②和④两种元素中,原子半径较大的是Al(填元素符号).
(3)元素①的氢氧化物与元素⑤的单质在常温下反应,化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O.
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
(2)④和⑤两种元素的最高价氧化物对应水化物酸性较弱的是H2SO4(填化学式),②和④两种元素中,原子半径较大的是Al(填元素符号).
(3)元素①的氢氧化物与元素⑤的单质在常温下反应,化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O.
8.在一定温度下,反应:2A(s)+2B(g)?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
| A. | A的质量不再改变 | |
| B. | 混合气的密度不再随时间而变化 | |
| C. | 容器内的压强不随时间而变化 | |
| D. | 单位时间内生成2a mol B,同时生成a mol C |
18.一氧化氮对空气说:一看到你我就会脸红,可逆反应2NO(g)+O2(g)?2NO2(g) 达到平衡状态时的标志是( )
| A. | 混合气体的密度不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 正反应速率与逆反应速率相等均为零 | |
| D. | 反应物与生成物浓度相等 |
5.利尿酸是奥运会禁止使用的兴奋剂之一,其结构简式如图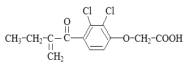 .下列有关利尿酸的说法中正确的是( )
.下列有关利尿酸的说法中正确的是( )
 .下列有关利尿酸的说法中正确的是( )
.下列有关利尿酸的说法中正确的是( )| A. | 分子式是C13H14O4Cl2 | |
| B. | 1mol利尿酸最多能与5mol H2发生加成反应 | |
| C. | 一定条件下能发生加聚、缩聚反应 | |
| D. | 分子内处于同一平面内的原子不超过10个 |
3.已知2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,关于该反应的下列说法错误的是( )
| A. | 该反应是一个放热反应 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| C. | 该反应是一个吸热反应 | |
| D. | 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 |
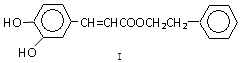

 或
或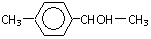 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液、加热.