题目内容
同温同压下,下列各组化学方程式中Q2>Q1的是( )
| A、2H2(g)+O2(g)═2H2O(l)△H=-Q1kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-Q2kJ/mol | ||||
| B、S(g)+O2(g)═SO2(g)△H=-Q1kJ/mol S(s)+O2(g)═SO2(g)△H=-Q2kJ/mol | ||||
| C、C(s)+1/2O2(g)═CO(g)△H=-Q1kJ/mol C(s)+O2(g)═CO2(g)△H=-Q2kJ/mol | ||||
D、H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol
|
考点:反应热的大小比较
专题:化学反应中的能量变化
分析:选项中的反应都为放热反应,由热化学方程式可知Q越大,放出的热量越多,物质反应的越彻底,参加反应的物质的量越多,放出的热量越多,物质的聚集状态不同,Q不同,以此解答该题.
解答:
解:A.H2O(g)→H2O(l)为放热过程,则Q1>Q2,故A错误;
B.S(s)→S(g)为吸热过程,则Q1>Q2,故B错误;
C.因CO(气)→CO2(气)为放热过程,后者氧化更彻底,放出的热量更多,则Q2>Q1,故C正确;
D.参加反应的物质的量越多,放出的热量越多,则Q2<Q1,故D错误.
故选C.
B.S(s)→S(g)为吸热过程,则Q1>Q2,故B错误;
C.因CO(气)→CO2(气)为放热过程,后者氧化更彻底,放出的热量更多,则Q2>Q1,故C正确;
D.参加反应的物质的量越多,放出的热量越多,则Q2<Q1,故D错误.
故选C.
点评:本题考查反应热的大小比较,题目难度中等,本题注意比较反应热的角度,化学反应中,反应的程度、物质的量以及物质的聚集状态不同,反应放出或吸收的热量是不同的.

练习册系列答案
相关题目
常温下,下列不能共存的分子组( )
| A、N2、O2、CO2、H2 |
| B、N2、H2、H2O(g)、CO |
| C、NH3、Cl2、HCl、H2 |
| D、CO、CO2、O2、HCl |
0.3mol气态高能燃料乙硼烷B2H6在O2中燃烧,生成固态B2O3和液态H2O,放出649.5kJ的热量.下列热化学方程式正确的是( )
| A、B2H6(g)+302(g)═B2O3(s)+3H2O(l)△H=2165 kJ?mol-1 |
| B、B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165 kJ?mol-1 |
| C、B2H6+3O2═B2O3+3H2O△H=-2165 kJ?mol-1 |
| D、B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2165 kJ?mol-1 |
取含有 0.02mol 的硫酸溶液,先投入 0.24g 镁粉,再滴入NaOH 溶液,当使溶液中的镁离子全部转化为沉淀时,需要NaOH的物质的量为( )
| A、0.02mol |
| B、0.03mol |
| C、0.04mol |
| D、0.01mol |
与Mg相比,Al( )
| A、金属性更大 |
| B、更难与碱反应 |
| C、半径更大 |
| D、更难与酸反应 |
下列实验装置正确且能达到实验目的是( )
A、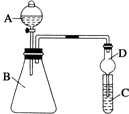 证明非金属性氯>碳>硅(A、B、C中的试剂分别为盐酸、石灰石和硅酸钠溶液) |
B、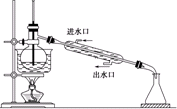 石油分馏 |
C、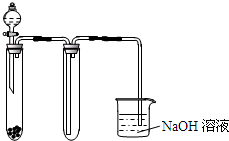 用KMnO4与浓盐酸反应制取适量氯气的简易装置 |
D、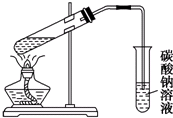 实验室制乙酸乙酯 |
下列化学方程式正确的是( )
A、S+O2
| ||||
B、4Al+3O2
| ||||
C、P+O2
| ||||
D、Mg+O2
|
下列关于常见有机化合物的说法中,正确的是( )
| A、乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B、甲烷和苯都不能使酸化的KMnO4溶液褪色,也均不能发生氧化反应 |
| C、乙醇、乙酸、乙酸乙酯都能发生取代反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |