题目内容
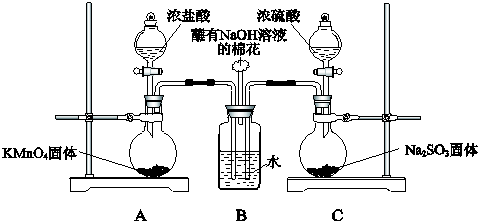
16.在硫酸工业的下列设备中,硫元素的价态不发生变化的是在( )中
| A. | 沸腾炉 | B. | 接触室 | ||
| C. | 吸收塔 | D. | 三个设备中都有变 |
分析 ①沸腾炉发生反应为:2FeS2+11O2=2Fe2O3+8SO2;②接触室发生反应为:2SO2+O2?2SO3;③吸收塔发生反应为:SO3+H2O=H2SO4;根据反应过程中是否有元素化合价的变化来判断.
解答 解:A、沸腾炉发生反应为:2FeS2+11O2=2Fe2O3+8SO2是氧化还原反应,硫元素的价态发生变化,故A错误;
B、接触室发生反应为:2SO2+O2?2SO3,是氧化还原反应,硫元素的价态发生变化,故B错误;
C、吸收塔发生反应为:SO3+H2O=H2SO4,非氧化还原反应,硫元素的价态不发生变化,故C正确;
D、吸收塔发生反应为:SO3+H2O=H2SO4,非氧化还原反应,故D错误;
故选C.
点评 本题考查了接触法制硫酸的工业流程,设备作用,是基础题.

练习册系列答案
相关题目
6.现有常温下pH=2的盐酸甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),醋酸的电离平衡向左(填“向左”、“向右”或“不”)移动;常温下,另取10mL的乙溶液,加水稀释过程中,下列表达式的数据一定增大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(3)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子水解程度最大的是B.
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(4)常温下,取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
(1)取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),醋酸的电离平衡向左(填“向左”、“向右”或“不”)移动;常温下,另取10mL的乙溶液,加水稀释过程中,下列表达式的数据一定增大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(3)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(4)常温下,取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
6.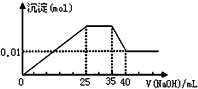 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
①第一份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为9.32g.
根据上述实验,以下推测不正确的是( )
 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:①第一份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为9.32g.
根据上述实验,以下推测不正确的是( )
| A. | 原溶液一定不存在H+、Cu2+、CO32-、Fe3+ | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |
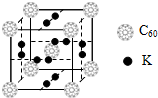 氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.根据要求回答有关问题:
氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.根据要求回答有关问题: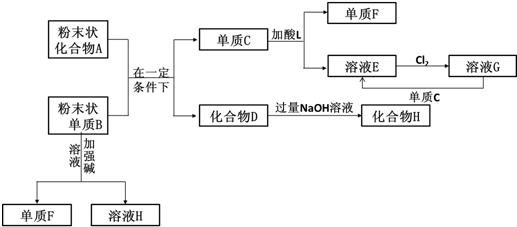
 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).