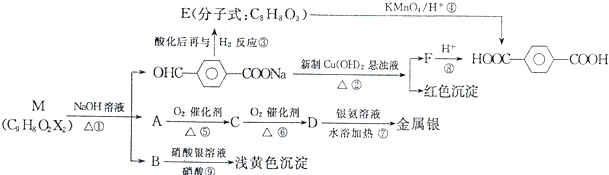
题目内容
金属钼(Mo)是人体及动植物必需的微量元素,也可以增强合金的某些机械性能和耐腐蚀性,图1是模拟化工生产中制备金属钼的实验流程图(已知钼酸为难溶于水和酸的黄色晶体):
请回答下列问题:
(1)步骤②和③反应完成后都要进行的操作是 ;步骤④用于盛放钼酸的仪器名称为 .
(2)在灼烧辉钼矿时发生化学反应:2MoS2+7O2
2MoO3+4SO2,当有1mol MoS2反应时,还原剂失去电子的物质的量为 ;步骤②中发生反应的离子方程式 .
(3)若实验需要480mL 2mol/L的稀硝酸,则配制时需要用量筒取 mL63%的浓硝酸(密度ρ=1.4g/cm3),所有仪器除量筒外还有烧杯、玻璃棒、胶头滴管和 .
(4)步骤⑥吸收尾气生成铵盐的化学方程式为 ,检验该铵盐中阴离子所需要的试剂为 .
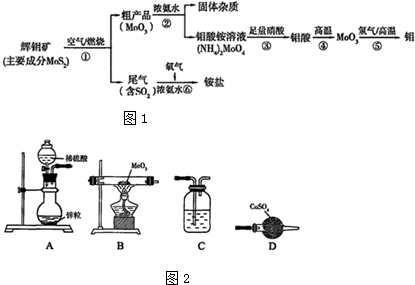
(5)若选用如图2装置完成步骤⑤的反应,同时检验该反应的氧化产物.
①实验步骤如下:连接好仪器,检查装置气密性,装入药品,打开分液漏斗活塞 → → → (请按正确的先后顺序填入下列步骤的代号).
a.收集气体并检验其纯度 b.停止加热,充分冷却
c.加热反应一段时间 d.关闭分液漏斗活塞,停止通氢气
②装置C中所盛的试剂是 (填试剂名称);证明装置B中已经发生反应的现象是 .
请回答下列问题:

(1)步骤②和③反应完成后都要进行的操作是
(2)在灼烧辉钼矿时发生化学反应:2MoS2+7O2
| ||
(3)若实验需要480mL 2mol/L的稀硝酸,则配制时需要用量筒取
(4)步骤⑥吸收尾气生成铵盐的化学方程式为
(5)若选用如图2装置完成步骤⑤的反应,同时检验该反应的氧化产物.
①实验步骤如下:连接好仪器,检查装置气密性,装入药品,打开分液漏斗活塞
a.收集气体并检验其纯度 b.停止加热,充分冷却
c.加热反应一段时间 d.关闭分液漏斗活塞,停止通氢气
②装置C中所盛的试剂是
考点:制备实验方案的设计
专题:实验设计题
分析:辉钼矿(主要成分是MoS2)在空气中燃烧生成MoO3和SO2,尾气含SO2用浓氨水吸收,并通入氧气生成硫酸铵;MoO3加浓氨水生成钼酸铵溶液,过滤除去杂质,在钼酸铵溶液中加足量硝酸,生成钼酸,钼酸为难溶于水和酸的黄色晶体,过滤得到钼酸晶体高温分解生成MoO3,在高温条件下用氢气还原得到金属钼;
(1)步骤②和③反应完成后都要进行的操作是分离固体和液体混合物;步骤④是高温分解钼酸;
(2)2MoS2+7O2
2MoO3+4SO2,根据当有1mol MoS2反应时,消耗的氧气的物质的量计算转移电子的物质的量;MoO3与浓氨水反应生成钼酸铵;
(3)若实验需要480mL 2mol/L的稀硝酸,需要用500ml容量瓶配制,根据物质的量守恒计算浓硝酸的体积;
(4)SO2用浓氨水吸收,并通入氧气生成硫酸铵;检验硫酸根离子用稀盐酸和氯化钡溶液;
(5)用锌与稀硫酸反应生成氢气,再浓硫酸干燥,然后再加热条件下还原MoO3,最后用无水硫酸铜检验生成的水;
(1)步骤②和③反应完成后都要进行的操作是分离固体和液体混合物;步骤④是高温分解钼酸;
(2)2MoS2+7O2
| ||
(3)若实验需要480mL 2mol/L的稀硝酸,需要用500ml容量瓶配制,根据物质的量守恒计算浓硝酸的体积;
(4)SO2用浓氨水吸收,并通入氧气生成硫酸铵;检验硫酸根离子用稀盐酸和氯化钡溶液;
(5)用锌与稀硫酸反应生成氢气,再浓硫酸干燥,然后再加热条件下还原MoO3,最后用无水硫酸铜检验生成的水;
解答:
解:辉钼矿(主要成分是MoS2)在空气中燃烧生成MoO3和SO2,尾气含SO2用浓氨水吸收,并通入氧气生成硫酸铵;MoO3加浓氨水生成钼酸铵溶液,过滤除去杂质,在钼酸铵溶液中加足量硝酸,生成钼酸,钼酸为难溶于水和酸的黄色晶体,过滤得到钼酸晶体高温分解生成MoO3,在高温条件下用氢气还原得到金属钼;
(1)步骤②和③反应完成后都要进行的操作是分离固体和液体混合物,所以操作名称为过滤;步骤④是高温分解钼酸,则所用的仪器为坩埚;
故答案为:过滤;坩埚;
(2)2MoS2+7O2
2MoO3+4SO2,当有1mol MoS2反应时,消耗的氧气的物质的量问3.5mol,则转移电子的物质的量为3.5mol×4=14mol;MoO3与浓氨水反应生成钼酸铵,其反应的离子方程式为:2NH3?H2O+MoO3═2NH4++MoO42-+H2O;
故答案为:14mol;2NH3?H2O+MoO3═2NH4++MoO42-+H2O;
(3)质量分数为65%、密度为1.4g/cm3的浓硝酸的浓度为:c=
mol/L=14.4mol/L,若实验需要480mL 2mol/L的稀硝酸,需要用500ml容量瓶配制,则2mol/L的稀硝酸的体积为500ml,溶液稀释前后溶质的物质的量不变,则:C浓?V浓=C稀?V稀,14.4mol/L×V浓=2mol/L×0.5L
解得:V浓=0.0714L=71.4ml;
故答案为:71.4;500ml容量瓶;
(4)SO2用浓氨水吸收,并通入氧气生成硫酸铵,其反应的化学方程式为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O;检验硫酸根离子应该先用稀盐酸排除干扰离子,再加氯化钡溶液,若有白色沉淀,则说明有硫酸根离子;
故答案为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O;稀盐酸和氯化钡溶液;
(5)用锌与稀硫酸反应生成氢气,再浓硫酸干燥,然后再加热条件下还原MoO3,最后用无水硫酸铜检验生成的水;
①实验步骤如下:连接好仪器,检查装置气密性,装入药品,打开分液漏斗活塞,收集氢气并检验其纯度,然后加热B装作反应一段时间,停止加热,继续通氢气,充分冷却,然后关闭分液漏斗活塞,停止通氢气,则操作顺序为a→c→b→d;
故答案为:a、c、b、d;
②装置C中所盛的试剂是用于干燥氢气,则试剂为浓硫酸;氢气还原MoO3生成水蒸气,使无水硫酸铜变蓝色;
故答案为:浓硫酸;无水硫酸铜变蓝色.
(1)步骤②和③反应完成后都要进行的操作是分离固体和液体混合物,所以操作名称为过滤;步骤④是高温分解钼酸,则所用的仪器为坩埚;
故答案为:过滤;坩埚;
(2)2MoS2+7O2
| ||
故答案为:14mol;2NH3?H2O+MoO3═2NH4++MoO42-+H2O;
(3)质量分数为65%、密度为1.4g/cm3的浓硝酸的浓度为:c=
| 1000×1.4×65% |
| 63 |
解得:V浓=0.0714L=71.4ml;
故答案为:71.4;500ml容量瓶;
(4)SO2用浓氨水吸收,并通入氧气生成硫酸铵,其反应的化学方程式为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O;检验硫酸根离子应该先用稀盐酸排除干扰离子,再加氯化钡溶液,若有白色沉淀,则说明有硫酸根离子;
故答案为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O;稀盐酸和氯化钡溶液;
(5)用锌与稀硫酸反应生成氢气,再浓硫酸干燥,然后再加热条件下还原MoO3,最后用无水硫酸铜检验生成的水;
①实验步骤如下:连接好仪器,检查装置气密性,装入药品,打开分液漏斗活塞,收集氢气并检验其纯度,然后加热B装作反应一段时间,停止加热,继续通氢气,充分冷却,然后关闭分液漏斗活塞,停止通氢气,则操作顺序为a→c→b→d;
故答案为:a、c、b、d;
②装置C中所盛的试剂是用于干燥氢气,则试剂为浓硫酸;氢气还原MoO3生成水蒸气,使无水硫酸铜变蓝色;
故答案为:浓硫酸;无水硫酸铜变蓝色.
点评:本题考查了物质的制备方案设计,主要考查了离子方程式、化学方程式的书写、氧化还原反应、物质的分离、物质的检验等知识点,难度较大,侧重于考查学生的实验能力和对基础知识的综合应用能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、pH<5的溶液:NH4+、Na+、S2-、Cl- |
| C、pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D、与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
在恒压条件下化学反应:2SO2(g)+O2(g)?2SO3(g);△H=-QkJ?mol-1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是( )
| 容器 | SO2(mol) | O2(mol) | SO3(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2 |
| 丙 | 0 | 0 | 2 | 0 | Q3 |
| 丁 | 1 | 0.5 | 0 | 1 | Q4 |
| A、平衡时,向甲容器中再加1mol O2,一段时间后达平衡时 O2的体积分数减小 |
| B、平衡时,升高丙容器温度,正反应速率增大,逆反应速率减小,平衡逆向移动 |
| C、各容器中反应放出热量的关系为:Q1=2Q2>2Q4,且Q1+Q3=Q |
| D、丁容器中反应达到平衡时,其化学平衡常数小于乙容器中反应的平衡常数 |
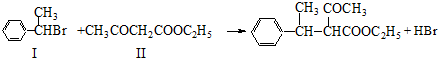
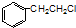 与一分子
与一分子 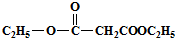 能发生类似①的反应,生成有机化合物Ⅴ,则Ⅴ的结构简式为
能发生类似①的反应,生成有机化合物Ⅴ,则Ⅴ的结构简式为