题目内容
(1)写出下列物质在水中的电离方程式:
KHSO4 ; H2SO3 ;NaHCO3 ; Al(OH)3
(2)写出下列物质发生水解的离子方程式:
NaHCO3 ; Na2S ;NH4Cl ; CuSO4
(3)写出下列各组溶液混合后反应的离子方程式:
AlCl3和Na2S溶液混合: Al2(SO4)3和NaHCO3溶液混合: .
KHSO4
(2)写出下列物质发生水解的离子方程式:
NaHCO3
(3)写出下列各组溶液混合后反应的离子方程式:
AlCl3和Na2S溶液混合:
考点:电离方程式的书写,离子方程式的书写
专题:
分析:(1)强电解质完全电离、弱电解质部分电离,硫酸氢钾、碳酸氢钠为强电解质,亚硫酸、氢氧化铝为弱电解质,然后根据电离方程式的书写原则完成;
(2)碳酸氢根离子水解生成碳酸和氢氧根离子;硫离子水解分步进行,水解方程式需要分步书写;铵根离子水解生成一水合氨和氢离子;铜离子水解生成氢氧化铜和氢离子;
(3)铝离子与硫离子、碳酸氢根离子能够发生双水解反应生成沉淀和气体.
(2)碳酸氢根离子水解生成碳酸和氢氧根离子;硫离子水解分步进行,水解方程式需要分步书写;铵根离子水解生成一水合氨和氢离子;铜离子水解生成氢氧化铜和氢离子;
(3)铝离子与硫离子、碳酸氢根离子能够发生双水解反应生成沉淀和气体.
解答:
解:(1)硫酸氢钾是强酸酸式盐,在溶液中完全电离产生钾离子、氢离子、硫酸根,电离方程式为:KHSO4=K++H++SO42-;
亚硫酸是多元弱酸分步电离,电离离子方程式为:H2SO3?H++HSO3-、HSO3-?H++SO32-;
碳酸氢根是弱酸的酸式酸根,碳酸氢钠电离产生钠离子与碳酸氢根,电离方程式为:NaHCO3=Na++HCO3-;
氢氧化铝为弱电解质,在溶液中电离出氢氧根离子和铝离子,电离方程式为:Al(OH)3?Al3++3OH-,
故答案为:KHSO4=K++H++SO42-;H2SO3?H++HSO3-、HSO3-?H++SO32-;NaHCO3=Na++HCO3-;Al(OH)3?Al3++3OH-;
(2)碳酸氢钠电离出的碳酸氢根离子部分水解生成碳酸和氢氧根离子,其水解的离子方程式为:HCO3-+H2O?H2CO3+OH-;
Na2S是二元弱酸氢硫酸的盐,水解离子方程式为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
铵根离子水解生成一水合氨和氢离子,水解的离子方程式为:NH4++H2O?NH3?H2O+H+;
铜离子水解生成氢氧化铜和氢离子,为可逆反应,水解离子反应为:Cu2++2H2O?Cu(OH)2+2H+,
故答案为:HCO3-+H2O?H2CO3+OH-;S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;Cu2++2H2O?Cu(OH)2+2H+;
(3)铝离子在溶液中水解生成氢氧化铝和氢离子,硫离子水解生成硫化氢和氢氧根离子,二者相互促进,则明矾溶液和Na2S水溶液混合发生的反应为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;
铝离子和碳酸氢根离子相互促进水解反应,生成沉淀和气体,水解离子反应为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;Al3++3HCO3-=Al(OH)3↓+3CO2↑.
亚硫酸是多元弱酸分步电离,电离离子方程式为:H2SO3?H++HSO3-、HSO3-?H++SO32-;
碳酸氢根是弱酸的酸式酸根,碳酸氢钠电离产生钠离子与碳酸氢根,电离方程式为:NaHCO3=Na++HCO3-;
氢氧化铝为弱电解质,在溶液中电离出氢氧根离子和铝离子,电离方程式为:Al(OH)3?Al3++3OH-,
故答案为:KHSO4=K++H++SO42-;H2SO3?H++HSO3-、HSO3-?H++SO32-;NaHCO3=Na++HCO3-;Al(OH)3?Al3++3OH-;
(2)碳酸氢钠电离出的碳酸氢根离子部分水解生成碳酸和氢氧根离子,其水解的离子方程式为:HCO3-+H2O?H2CO3+OH-;
Na2S是二元弱酸氢硫酸的盐,水解离子方程式为:S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;
铵根离子水解生成一水合氨和氢离子,水解的离子方程式为:NH4++H2O?NH3?H2O+H+;
铜离子水解生成氢氧化铜和氢离子,为可逆反应,水解离子反应为:Cu2++2H2O?Cu(OH)2+2H+,
故答案为:HCO3-+H2O?H2CO3+OH-;S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-;Cu2++2H2O?Cu(OH)2+2H+;
(3)铝离子在溶液中水解生成氢氧化铝和氢离子,硫离子水解生成硫化氢和氢氧根离子,二者相互促进,则明矾溶液和Na2S水溶液混合发生的反应为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;
铝离子和碳酸氢根离子相互促进水解反应,生成沉淀和气体,水解离子反应为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑;Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评:本题考查了电离方程式、水解方程式的书写,题目难度中等,试题知识点较多,注意掌握水解原理、电离方程式、水解方程式的书写方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
将22.6克Mg、Al、Fe溶于过量的1LpH=0的硫酸溶液中,然后向其中加入氢氧化钠溶液使Mg2+、Al3+、Fe2+刚好完全沉淀,用掉氢氧化钠溶液1升,则氢氧化钠溶液的浓度是( )
| A、1mol/L |
| B、2mol/L |
| C、3mol/L |
| D、0.5mol/L |
NA代表阿伏伽德罗常数,下列说法正确的是( )
| A、常温常压下,2g氢气所含有的氢原子的数目为NA |
| B、1molFe与足量的盐酸反应,失去的电子数为0.3NA |
| C、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| D、0.02 mol/L的NaCl溶液中含有Na+的数目是0.02 NA |
水热法制备Fe3O4纳米颗粒的反应为:3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下列说法不正确的是( )
| A、x=4 |
| B、每生成1 mol Fe3O4,反应共转移2 mol e- |
| C、Fe2+和S2O32-都是还原剂 |
| D、1 mol S2O32-被氧化时,被S2O32-还原的O2为0.25 mol |
下列各组物质中,第一种是含氧酸,第二种是混合物,第三种是碱的是( )
| A、爆鸣气、硫酸铜、硫酸 |
| B、水、空气、纯碱 |
| C、氧化铁、氨水、熟石灰 |
| D、硝酸、石灰石、烧碱 |
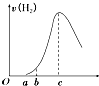 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图所示的坐标曲线来表示:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图所示的坐标曲线来表示:下列推论错误的是( )
| A、O→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液 |
| B、b→c段产生氢气的速率增加较快的主要原因之一是温度升高 |
| C、c点时反应处平衡状态 |
| D、t>c产生氢气的速率降低主要是因为溶液中c(H+)降低 |
 依据氧化还原反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)设计的原电池如图所示.
依据氧化还原反应Zn(s)+Cu2+(aq)═Zn2+(aq)+Cu(s)设计的原电池如图所示.