题目内容
19.设NA为阿佛加德罗常数,下列说法错误的是( )| A. | 在标准状况下,22.4L C5H10所含的碳原子数目为5NA | |
| B. | 常温常压下,7.8g过氧化钠含有的离子数为0.3NA | |
| C. | 18g水所含的电子数目为10NA | |
| D. | 3.2g O2、O3混合物中所含氧原子一定是0.2NA |
分析 A、标况下戊烷为液态;
B、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含2mol钠离子和1mol过氧根来分析;
C、求出水的物质的量,然后根据水中含10个电子来分析;
D、氧气和臭氧均由氧原子构成.
解答 解:A、标况下戊烷为液态,故不能根据气体摩尔体积来计算其物质的量和碳原子数,故A错误;
B、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠中含2mol钠离子和1mol过氧根,故0.1mol过氧化钠中含0.3mol离子即0.3NA个,故B正确;
C、18g水的物质的量为1mol,而水中含10个电子,故1mol水中含10NA个电子,故C正确;
D、氧气和臭氧均由氧原子构成,故3.2g混合物中含有的氧原子的物质的量为n=$\frac{3.2g}{16g/mol}$=0.2mol,个数为0.2NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
9.甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是( )
| A. | 甲醇、甲醛分子间都可以形成氢键 | |
| B. | 甲醇分子内C原子C原子采取sp2杂化,O原子采取sp杂化 | |
| C. | 甲醛为极性分子,分子中两个C-H键夹角小于120° | |
| D. | 甲醇分子内的O-C-H键角大于甲醛分子内的O-C-H键角 |
7.下列说法正确的是( )
| A. | 17g OH-中含有的电子数为10 NA | |
| B. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| C. | NA个Fe(OH)3胶体粒子的质量为107g | |
| D. | 44克14C16O2含氧原子数为2NA |
14.绿色能源是指使用不会对环境造成污染的能源.下列属于绿色能源的是( )
①太阳能 ②风能 ③潮汐能 ④煤 ⑤天然气 ⑥石油.
①太阳能 ②风能 ③潮汐能 ④煤 ⑤天然气 ⑥石油.
| A. | ①②③ | B. | ③④ | C. | ④ | D. | ①② |
4.氢化铵(NH4H)与氯化铵的结构相似,又知它与水反应有气体生成.下列关于氢化铵叙述不正确的是( )
| A. | 是离子化合物,含有离子键和共价键 | |
| B. | 电子式是: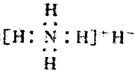 | |
| C. | 与水反应时,是还原剂 | |
| D. | 固体投入少量的水中,有两种气体产生 |
8.下列有关说法正确的是( )
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 铅蓄电池在放电时,两极质量均增加 | |
| C. | 钢铁在中性溶液中主要繁盛析氢腐蚀 | |
| D. | 在室温下能自发进行的反应,其△H一定小于0 |
9.C4H8Cl2共有几种同分异构体( )
| A. | 6 | B. | 8 | C. | 9 | D. | 10 |
 .
. .
.