题目内容
4.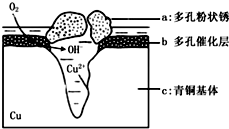 图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.
图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.(1)腐蚀过程中,负极是c(填图中字母“a”或“b”或“c”);
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应物作用生成多孔粉状锈Cu2(OH)3Cl,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓.
(3)若生成4.29gCu2(OH)3Cl,则理论上消耗体积为0.448L(标况).
(4)写出Fe发生吸氧腐蚀时的正极反应方程式O2+4e-+2H2O═4OH-.
分析 (1)根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极;
(2)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀;
(3)n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子计算氧气物质的量,再根据V=nVm计算体积;
(4)铁发生吸氧腐蚀的正极氧气得到电子发生还原反应.
解答 解:(1)根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,故答案为:c;
(2)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(3)n[Cu2(OH)3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol,根据转移电子得n(O2)=$\frac{0.02mol×2×2}{4}$=0.02mol,V(O2)=0.02mol×22.4L/mol=0.448L,
故答案为:0.448;
(4)铁发生吸氧腐蚀正极氧气得到电子发生还原反应,反应式为:O2+4e-+2H2O═4OH-;故答案为:O2+4e-+2H2O═4OH-.
点评 本题考查了原电池原理及电极反应式、电池反应式的书写及其计算,难度中等,掌握原理是解题关键.

| A. | 用烧杯可以精确配制0.1mol/L的NaOH溶液 | |
| B. | 用淀粉溶液检验某溶液中是否存在碘单质 | |
| C. | 可利用丁达尔效应区分胶体与溶液 | |
| D. | 用苯可以萃取溴水中的溴单质 |
| A. | 闻化学药品的气味时都不能使鼻子凑近药品 | |
| B. | 点燃可燃性气体之前要先检查纯度,以免发生爆炸 | |
| C. | 金属钠着火时应使用干燥的沙土灭火 | |
| D. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
| A. | 平衡时,将生成的水蒸气除去,有利于提高HCl的转化率 | |
| B. | 在恒容绝热容器中进行时,随着反应的进行,气体的压强一定不断减小 | |
| C. | 恒压容器中,反应到平衡后通入惰性气体,平衡不移动 | |
| D. | 平衡时,其他条件不变,增大催化剂用量,反应的平衡常数将变大 |
| A. | 甲烷与氯气发生取代反应,只能生成一氯甲烷 | |
| B. | 乙醇和乙酸都可以与钠反应生成氢气 | |
| C. | 苯和乙烯均能与溴水发生加成反应使溴水褪色 | |
| D. | 甲醛易溶于水,其水溶液具有杀菌消毒作用,可用于浸泡海鲜食品 |
 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下: