题目内容
某实验小组设计了下列装置进行氨的催化氧化实验.
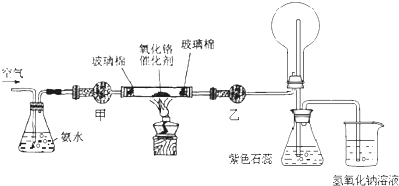
(1)常温下,用5.8mol/L的氨水时实验现象明显,现用浓氨水配制该浓度的氨水480mL,需要烧杯、玻璃棒,还需要的玻璃仪器有 .
(2)甲处药品的名称为 .
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是 (填“吸”或“放”)热反应,化学方程式为 ;乙处加入无水氯化钙,烧瓶中发生反应的化学方程式为 ;锥形瓶中产生的现象为 .
(4)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生的现象为 .
(5)现用镁与石墨作电极,浓氯化铵溶液作电解液构成原电池,正极的电极反应式为 .

(1)常温下,用5.8mol/L的氨水时实验现象明显,现用浓氨水配制该浓度的氨水480mL,需要烧杯、玻璃棒,还需要的玻璃仪器有
(2)甲处药品的名称为
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是
(4)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生的现象为
(5)现用镁与石墨作电极,浓氯化铵溶液作电解液构成原电池,正极的电极反应式为
考点:氨的制取和性质
专题:实验题
分析:(1)可以量取溶液体积混合得到,依据溶液配制的过程和步骤分析判断需要的玻璃仪器;
(2)甲处是干燥氨气需要用碱石灰;
(3)氨气的催化氧化生成一氧化氮和水,反应是放热反应;
(4)缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟.是因为氮氧化物和空气混合通入水中反应生成硝酸和过量氨气生成硝酸铵固体小颗粒;
(5)铵根离子在原电池的正极上得到电子发生还原反应.
(2)甲处是干燥氨气需要用碱石灰;
(3)氨气的催化氧化生成一氧化氮和水,反应是放热反应;
(4)缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟.是因为氮氧化物和空气混合通入水中反应生成硝酸和过量氨气生成硝酸铵固体小颗粒;
(5)铵根离子在原电池的正极上得到电子发生还原反应.
解答:
解:(1)浓氨水,可以量取溶液体积混合得到,利用量筒量取氨水和水在烧杯中混合后,用玻璃棒搅拌得到配制的溶液;
故答案为:量筒、胶头滴管、500mL容量瓶;
(2)甲处是干燥氨气需要用碱石灰,防止水蒸气进入玻璃管炸裂玻璃管,乙处是干燥一氧化氮气体用氯化钙,不吸收后再后续装置会生成白烟;氨气不能用氯化钙干燥;甲处:碱石灰;
故答案为:碱石灰;
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,反应是放热反应,发生的是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2
4NO+6H2O,锥形瓶中NO2与H2O反应生成硝酸,使紫色石蕊变红,
故答案为:放热反应; 4NH3+5O2
4NO+6H2O;2 NO+O2=2NO2;溶液变红;
(4)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟,氨气被氧化生成一氧化氮,一氧化氮和空气中的氧气反应生成二氧化氮,通入水中反应生成硝酸,硝酸和过量的氨气反应生成硝酸铵固体小颗粒,冒白烟;
故答案为:有红棕色气体生成,产生白烟;
(5)镁与石墨作电极,浓氯化铵溶液作电解液,镁做负极,铵根离子做正极,反应式为2NH4++2e-=2NH3↑+H2↑,故答案为:2 NH4++2e-=2NH3↑+H2↑.
故答案为:量筒、胶头滴管、500mL容量瓶;
(2)甲处是干燥氨气需要用碱石灰,防止水蒸气进入玻璃管炸裂玻璃管,乙处是干燥一氧化氮气体用氯化钙,不吸收后再后续装置会生成白烟;氨气不能用氯化钙干燥;甲处:碱石灰;
故答案为:碱石灰;
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,反应是放热反应,发生的是氨气的催化氧化反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2
| ||
| △ |
故答案为:放热反应; 4NH3+5O2
| ||
| △ |
(4)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生白烟,氨气被氧化生成一氧化氮,一氧化氮和空气中的氧气反应生成二氧化氮,通入水中反应生成硝酸,硝酸和过量的氨气反应生成硝酸铵固体小颗粒,冒白烟;
故答案为:有红棕色气体生成,产生白烟;
(5)镁与石墨作电极,浓氯化铵溶液作电解液,镁做负极,铵根离子做正极,反应式为2NH4++2e-=2NH3↑+H2↑,故答案为:2 NH4++2e-=2NH3↑+H2↑.
点评:本题考查了氨气实验室制备,性质验证方法,氨气的催化氧化反应,气体干燥试剂选择,产物吸收,过程反应化学方程式的书写,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
已知某有机物的分子式为C3HaOb(a、b均是正整数).则下列说法中正确的是( )
| A、当a=8,b=3时,该物质可能发生加成反应 |
| B、无论b值大小.a都不可能为奇数 |
| C、当a=6,b=2时,该物质不可能含有两种官能团 |
| D、当a=6,b=2时,该物质属于酯类物质的同分异构体共有4种 |
实验室常用KClO3晶体和浓盐酸反应制取氯气,反应的化学方程式为KClO3++6HCl(浓)═KCl+3Cl2↑+3H2O.
(1)氧化产物是 ,还原产物是 ;
(2)被氧化与被还原的氯原子的数目比是 .
(1)氧化产物是
(2)被氧化与被还原的氯原子的数目比是
下列物质的检验,其结论一定正确的是( )
| A、向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- |
| B、向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- |
| C、取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
| D、能使湿润的碘化钾淀粉试纸变蓝的一定是Cl2 |
 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成: