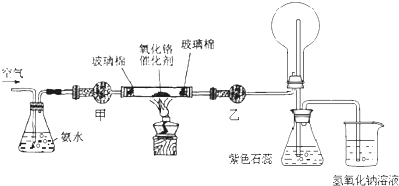
题目内容
欲用含少量氯化钙的氯化钠固体,配制100ml amol/L的氯化钠溶液,设计了下面的操作方案.根据方案操作步骤回答下列问题:
(1)称量粗盐样品mg,在托盘天平左盘上放 ,右盘上放 .
(2)过滤时,漏斗下端管口应 ,漏斗里液面应 .
(3)蒸发操作时应将液体放在 中加热,等加热至 时即停止加热.
(4)为除去氯化钙应加入 ,反应的化学方程式 .所得滤液蒸发前应 ,目的是 .
(5)配制100mL amol/L的氯化钠溶液时,应从提纯后的固体中称取NaCl的质量为 ,配制时应在 中进行定容.
(1)称量粗盐样品mg,在托盘天平左盘上放
(2)过滤时,漏斗下端管口应
(3)蒸发操作时应将液体放在
(4)为除去氯化钙应加入
(5)配制100mL amol/L的氯化钠溶液时,应从提纯后的固体中称取NaCl的质量为
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)称量时左物右码;
(2)过滤时“一贴”、“二低”、“三靠”;
(3)蒸发在蒸发皿中进行,当加热到剩有少量液体时停止加热用余热蒸干;
(4)加入过量碳酸钠与氯化钙反应,除去溶液中的钙离子,并据反应原理书写方程式;所得滤液蒸发前应用盐酸除去过量的碳酸钠;
(5)根据n=cv,m=nM计算,配制时应在容量瓶中进行定容.
(2)过滤时“一贴”、“二低”、“三靠”;
(3)蒸发在蒸发皿中进行,当加热到剩有少量液体时停止加热用余热蒸干;
(4)加入过量碳酸钠与氯化钙反应,除去溶液中的钙离子,并据反应原理书写方程式;所得滤液蒸发前应用盐酸除去过量的碳酸钠;
(5)根据n=cv,m=nM计算,配制时应在容量瓶中进行定容.
解答:
解:(1)称量时左物右码,因此粗盐放在托盘天平的左盘,砝码放在托盘天平的右盘,故答案为:粗盐;砝码;
(2)过滤时,漏斗下端管口应靠在烧杯内壁上,漏斗里液面应低于滤纸的边缘,故答案为:靠在烧杯内壁上;低于滤纸的边缘;
(3)蒸发操作时应将液体放在蒸发皿中加热,等加热至剩余较少液体时即停止加热,故答案为:蒸发皿;剩余较少液体;
(4)粗盐中含有氯化钙,加入碳酸钠溶液后,氯化钙与碳酸钠溶液反应生成碳酸钙沉淀 和氯化钠,使钙离子完全形成沉淀而除去,化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl;所得滤液中含有过量的碳酸钠,加过量的盐酸除去碳酸钠,化学方程式为 Na2CO3+2HCl═2NaCl+H2O+CO2↑,
故答案为:碳酸钠;Na2CO3+CaCl2═CaCO3↓+2NaCl;盐酸;除去过量的碳酸钠;
(5)100 mL amol/L的NaCl溶液只溶质的质量m=nM=cvM=0.1L×amol/L×58.5g/mol=5.85ag,配制时应在100mL容量瓶中进行定容,
故答案为:5.85ag;100mL容量瓶.
(2)过滤时,漏斗下端管口应靠在烧杯内壁上,漏斗里液面应低于滤纸的边缘,故答案为:靠在烧杯内壁上;低于滤纸的边缘;
(3)蒸发操作时应将液体放在蒸发皿中加热,等加热至剩余较少液体时即停止加热,故答案为:蒸发皿;剩余较少液体;
(4)粗盐中含有氯化钙,加入碳酸钠溶液后,氯化钙与碳酸钠溶液反应生成碳酸钙沉淀 和氯化钠,使钙离子完全形成沉淀而除去,化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl;所得滤液中含有过量的碳酸钠,加过量的盐酸除去碳酸钠,化学方程式为 Na2CO3+2HCl═2NaCl+H2O+CO2↑,
故答案为:碳酸钠;Na2CO3+CaCl2═CaCO3↓+2NaCl;盐酸;除去过量的碳酸钠;
(5)100 mL amol/L的NaCl溶液只溶质的质量m=nM=cvM=0.1L×amol/L×58.5g/mol=5.85ag,配制时应在100mL容量瓶中进行定容,
故答案为:5.85ag;100mL容量瓶.
点评:本题考查粗盐的提纯、溶液的配制及化学方程式的书写,物质的量公式计算,注重对学生应用知识分析、解决问题能力的考查,题目难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
下图为向25ml0.1mol/LNaOH溶液中逐滴0.2mol/L醋酸溶液,当滴定至B点时,pH=7,溶液呈中性,下列关系式错误的是( )
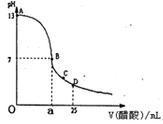

| A、c(H+)=c(OH-) |
| B、c(Na+)=c(CH3COO-) |
| C、a=12.5 |
| D、a>12.5 |
某同学配制一定物质的量浓度的硫酸溶液,下列情况会造成所配溶液浓度偏低的是( )
| A、定容时时俯视刻度线 |
| B、量筒量取5ml浓硫酸时俯视读数 |
| C、容量瓶中有蒸馏水 |
| D、溶解后未经冷却就转移到容量瓶进行定容 |
下列实验操作中,正确的是( )
| A、蒸发结晶时,应将溶液蒸干后才停止加热 |
| B、蒸馏中,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 |
| D、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释至刻度线 |