题目内容
19.实验室常用的几种气体发生装置如图A、B、C所示: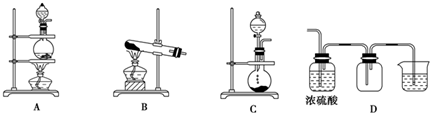
(1)实验室可以用B或C装置制取氧气:
Ⅰ、如果用B装置,通常使用的药品是氯酸钾和二氧化锰(或高锰酸钾);
Ⅱ、如果用C装置,通常使用的药品是过氧化氢溶液和二氧化锰;
Ⅲ、检查B装置气密性的操作方法是将导气管通入水槽中,用酒精灯微热(或用手捂住)试管,如果导管口有气泡产生,松开手或停止加热,冷却后,在导管里回升一段水柱,则说明B装置气密性良好.
(2)气体的性质是气体收集方法选择的主要依据.下列性质与收集方法无关的是②④(填序号,下同).
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的③.
①CO2 ②H2 ③Cl2
Ⅰ、写出A装置中反应的离子方程式并用单线桥标出电子转移方向和数目:
 .
.Ⅱ、D装置中连接小烧杯中应盛放NaOH溶液,目的是吸收尾气Cl2,防止污染空气.
Ⅲ、若要收集干燥纯净的X气体,上述装置应如何改进:在浓硫酸的洗气瓶前加一个装有饱和NaCl溶液的洗气瓶.
分析 (1)实验室制取氧气常用高锰酸钾或氯酸钾与二氧化锰在加热条件下分解制备氧气或用过氧化氢在二氧化锰作催化剂条件下分解制备氧气,前者需要加热,后者无需加热,检查B装置气密性是否良好的操作方法是将导管插入水中,用手捂住试管,看到气泡冒出,松开手后,在导管形成一段水柱,说明装置气密性良好;
(2)收集气体的方法的选择可依据气体的密度和溶解性,如气体与氧气反应则只能用排水法收集;
(3)若用A装置与D装置相连制取并收集X气体,为固体与液体反应需要加热装置,且气体可利用浓硫酸干燥、向上排空气法收集,需要尾气处理;
Ⅰ.A装置中反应是二氧化锰和浓盐酸加热反应生成氯气、氯化锰和水,HCl做还原剂,MnO2做氧化剂,标注元素化合价变化计算电子转移总数,据此书写离子方程式并用单线桥标出电子转移方向和数目;
Ⅱ.D装置中连接烧杯的目的是用来吸收尾气,防止污染空气,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
Ⅲ.生成的氯气中含氯化氢气体和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气.
解答 解:(1)Ⅰ.如果用B装置,实验室制取氧气常用高锰酸钾或氯酸钾与二氧化锰在加热条件下分解制备氧气,
故答案为:氯酸钾和二氧化锰(或高锰酸钾);
Ⅱ.如果用C装置,用过氧化氢在二氧化锰作催化剂条件下分解制备氧气,无需加热,如果用C装置,通常使用的药品是H2O2和MnO2,
故答案为:过氧化氢溶液和二氧化锰;
Ⅲ.检查B装置气密性是否良好的操作方法是将导管插入水中,用酒精灯微热(或用手捂住)试管,如果导管口有气泡产生,松开手或停止加热,冷却后,在导管里回升一段水柱,则说明B装置气密性良好,
故答案为:H2O2和MnO2;将导气管通入水槽中,用酒精灯微热(或用手捂住)试管,如果导管口有气泡产生,松开手或停止加热,冷却后,在导管里回升一段水柱,则说明B装置气密性良好;
(2)收集气体的方法的选择可依据气体的密度和溶解性,如气体与氧气反应则只能用排水法收集,气体是否有颜色、气体稳定性与收集方法无关,
故答案为:②④;
(3)AD连接是利用向上排气法收集气体;吸收装置是能用液体吸收气体防止污染空气;制取CO2时不需要加热也不不必处理尾气,NO常温下与氧气发生反应,不能用向下排空气法收集,氢气尾气处理时一般采用点燃的方法,故X可能是氯气,D装置中连接烧杯的目的是用来吸收尾气,防止污染空气,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:③;
Ⅰ、A装置中反应是二氧化锰和浓盐酸加热反应生成氯气、氯化锰和水,HCl做还原剂,MnO2做氧化剂,锰元素化合价+4价变化为+2价,电子转移2e-,HCl中氯元素化合价-1价变化为0价,电子转移2e-,则反应的离子方程式并用单线桥标出电子转移方向和数目为: ,
,
故答案为: ;
;
Ⅱ、D装置中连接烧杯的目的是用来吸收尾气,防止污染空气,发生反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:NaOH溶液;吸收尾气Cl2,防止污染空气;
Ⅲ、生成的氯气中含氯化氢气体和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,若要收集干燥纯净的X气体,上述装置应在浓硫酸的洗气瓶前加一个装有饱和NaCl溶液的洗气瓶,
故答案为:在浓硫酸的洗气瓶前加一个装有饱和NaCl溶液的洗气瓶.
点评 本题考查实验装置的综合应用,为高频考点,把握常见气体的制备原理、实验装置及气体的性质为解答的关键,侧重分析与实验能力的考查,题目难度中等.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案| A. | 原子半径:W>Z>Y>X | |
| B. | X、Y和Z三种元素形成的化合物中一定含有离子键和共价键 | |
| C. | 化合物YX3溶解于水中促进了水的电离 | |
| D. | Y的最高价氧化物对应的水化物一定有强氧化性 |
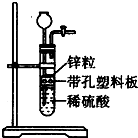 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④汽油⑤Na2C03溶液⑥KCl溶液( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④汽油⑤Na2C03溶液⑥KCl溶液( )| A. | ①②③ | B. | ②④⑤ | C. | ②③④⑥ | D. | ②③⑥ |
| A. | 偏高 | B. | 偏低 | ||
| C. | 不变 | D. | 三种情况均有可能 |
| A. | Cl2:电解饱和食盐水 | B. | O2:过氧化氢与二氧化锰混合 | ||
| C. | H2:锌粒和稀硝酸混合 | D. | NH3:氮气和氢气混合 |
CuO+2HCl═CuCl2+H2O FeO+2HCl═FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是( )
| A. | 直接加碱,调整溶液pH≥9.6 | |
| B. | 加足量的铜粉,将Fe2+还原出来 | |
| C. | 加足量的锌粉,将Fe2+还原出来 | |
| D. | 先将Fe2+氧化成Fe3+,再调整pH在3~4 |
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
