题目内容
2.下列叙述,错误的是( )| A. | 从上至下,卤素单质的密度依次增大,碱金属单质的密度也依次增大 | |
| B. | 从上至下,卤素单质的沸点逐渐升高,碱金属单质的熔点逐渐降低 | |
| C. | 除了I2外,其它卤素单质都能将Fe氧化到+3价 | |
| D. | F2不能从NaCl溶液中置换出Cl2 |
分析 A、碱金属中钠的密度大于钾的密度;
B、卤素单质是分子晶体卤素单质的熔沸点随着原子半径增大而升高,碱金属单质的熔沸点逐渐降低;
C、卤素单质的氧化性从上到下逐渐减弱;
D、F2能和NaCl溶液中的水剧烈反应产生氧气.
解答 解:A、碱金属和卤素单质的密度都依次变大,但是钠钾反常,钠的密度大于钾的密度,故A错误;
B、卤素单质是分子晶体,分子晶体的熔沸点与其相对分子质量成正比,所以卤素单质的熔沸点随着原子半径增大而升高,碱金属单质的熔沸点逐渐降低,故B正确;
C、卤素单质的氧化性从上到下逐渐减弱,除了I2外,其它卤素单质都能将Fe氧化到+3价,故C正确;
D、F2能和NaCl溶液中的水剧烈反应产生氧气,不能从NaCl溶液中置换出氯气,故D正确.
故选A.
点评 本题以碱金属族、卤族元素为例考查同一主族元素性质递变规律,同时考查学生灵活运用知识能力,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
13.下列关于氯水的叙述中,正确的是( )
| A. | 新制氯水中没有氯气分子 | |
| B. | 新制氯水在光照的条件下,可以产生气体,该气体是氯气 | |
| C. | 新制氯水中滴加硝酸银溶液,没有任何现象 | |
| D. | 新制氯水可以使干燥的布条褪色 |
10.将[H+]相同的CH3COOH溶液和HCl溶液分别用蒸馏水稀释到原来体积的m倍和n倍,若稀释后两溶液中[H+]仍然相同,则m和n的关系是( )
| A. | m>n | B. | m<n | C. | m=n | D. | 不能确定 |
17.下列状态时,不能导电的是( )
| A. | 液态氯化氢 | B. | 熔融态的食盐 | C. | 硫酸铜溶液 | D. | 氯水 |
14.如表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:HClO4,碱性最强的化合物的电子式是: .
.
(2)⑤最高价氧化物是两性氧化物,写出该氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)⑥、⑦、⑨三种元素形成的离子电子层结构相同,则三种离子半径由大到小的顺序是S2->Cl->K+(要求用离子符号表示).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)⑤最高价氧化物是两性氧化物,写出该氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)用电子式表示元素④与⑥的化合物的形成过程:

(4)⑥、⑦、⑨三种元素形成的离子电子层结构相同,则三种离子半径由大到小的顺序是S2->Cl->K+(要求用离子符号表示).
11.相同质量的下列烃,完全燃烧时,需要氧气最少的是( )
| A. | CH4 | B. | C2H4 | C. | C3H6 | D. | C2H2 |
9.下列说法中,正确的是( )
| A. | 由分子构成的物质中一定含有共价键 | |
| B. | 形成共价键的元素不一定是非金属元素 | |
| C. | 正四面体结构的分子中的键角一定是109°28′ | |
| D. | ClO2-的空间构型为直线型 |
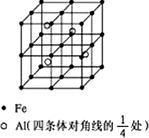 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.