题目内容
1. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )| A. | 溶液中K+向电极b移动 | |
| B. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| C. | 氨气在电极a上发生氧化反应 | |
| D. | 正极的电极反应式为:O2+4e-+2H20=4OH- |
分析 NH3被氧化为常见无毒物质,应生成氮气,Pt电子通入氨气生成氮气,为原电池负极,则b为正极,氧气得电子被还原,结合电极方程式解答该题.
解答 解:A.因为a极为负极,b为正极,则溶钙离子向正极移动,故A正确;
B.反应中N元素化合价升高3价,O元素化合价降低4价,根据得失电子守恒,消耗NH3与O2的物质的量之比为4:3,故B错误;
C.氨气在反应中失去电子在负极a极上发生氧化反应,故C正确;
D.正极得到电子发生还原反应,电极反应式为O2+4e-+2H20=4OH-,故D正确.
故选B.
点评 本题考查了原电池原理,根据O、N元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,为易错点.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
11.CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用分别是( )
| A. | 分子间作用力,离子键 | B. | 化学键,分子间作用力 | ||
| C. | 化学键,化学键 | D. | 分子间作用力,分子间作用力 |
12.研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如下图所下列说怯错误的是( )
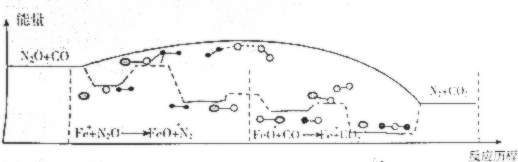

| A. | N2O与CO反应的△H<0 | |
| B. | FeO+也是该反应的催化剂 | |
| C. | Fe+使该反应的活化能减小 | |
| D. | Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热反应 |
9.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠的电子式: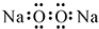 | |
| B. | 乙醇的分子式:C2H5OH | |
| C. | 硫离子的结构示意图: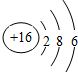 | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
16.固体NH5属离子化合物,它与水反应的方程式为:NH5+H2O═NH3•H2O+H2↑,它也能跟乙醇、乙酸、盐酸等发生类似的反应,并都产生氢气.下列有关NH5叙述正确的是( )
| A. | 1mol NH5中含有3NA个N-H键 | |
| B. | NH5中N元素的化合价为-5价 | |
| C. | 1mol NH5与水反应时,转移电子为NA | |
| D. | 与乙酸反应时,NH5被还原 |
10.直接分离苯和水的混合物需选用的仪器是( )
| A. |  | B. |  | C. |  | D. |  |
11.为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题.针对这一现象,某化学学习研究性小组提出如下方案,你认为不合理的是( )
| A. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| B. | 加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用 | |
| C. | 研制推广以乙醇为燃料的汽车或大力推广电动汽车 | |
| D. | 生产、生活中,努力实现资源的循环利用 |
