题目内容
15.pH的计算公式为pH=-lgc(H+),25℃时,Kw=10-14,0.01mol•L-1HCl溶液的pH=2,0.01mol•L-1NaOH溶液的pH=12.分析 pH=-lgc(H+);水的离子积和温度有关;求出盐酸溶液中的氢离子浓度,然后根据pH=pH=-lgc(H+)计算;先求出氢氧化钠溶液中的氢氧根的浓度,然后根据c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$来计算.
解答 解:pH=-lgc(H+);水的离子积和温度有关,当温度为25℃时,Kw=10-14;0.01mol/L盐酸溶液中的氢离子浓度为0.01mol/L,故pH=pH=-lgc(H+)=2;0.01mol/L氢氧化钠溶液中的氢氧根的浓度为0.01mol/L,故c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,故pH=12.
故答案为:pH=-lgc(H+);10-14;2;12;
点评 本题考查了溶液pH的计算,难度不大,注意pH的计算公式的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.如表是不同温度下水的离子积常数:
试回答以下问题:
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
10.下列物质既能与强酸反应,也能与强碱反应的是( )
①Al ②Al2O3③Al(OH)3 ④NaHSO3⑤(NH4)2CO3⑥(CH3COO)2Cu⑦NH2-CH2-COOH.
①Al ②Al2O3③Al(OH)3 ④NaHSO3⑤(NH4)2CO3⑥(CH3COO)2Cu⑦NH2-CH2-COOH.
| A. | ①②③⑦ | B. | 除⑤⑥外 | C. | ②③⑦ | D. | 全部 |
16.实验室用标准盐酸测定NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
| A. | 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 | |
| D. | 锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管内液面所在刻度 |
17.阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:

主要试剂和产品的物理常数如下表所示:
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐和水易发生反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:

①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:

主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐和水易发生反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:

①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
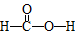 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: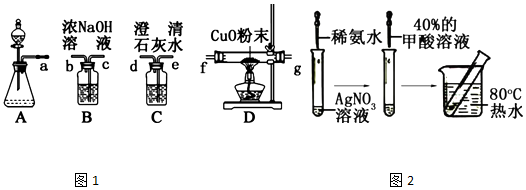
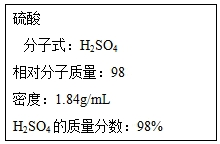 根据要求回答下列问题:
根据要求回答下列问题: