题目内容
18.1mol H2SO4含有2mol氢原子,4mol氧原子,4mol硫原子.0.2g氢气跟9.8gH2SO4所含氢原子数相同.49gH2SO4和9g水含有相同的分子数.分析 由硫酸的组成可知:n(H)=2n( H2SO4);n(O)=4n( H2SO4);n(S)=n( H2SO4);氢气与硫酸氢原子数相等符合:n(H2)=n( H2SO4);等物质的量硫酸与等物质量的水的分子数相等,由此分析解答.
解答 解:1mol H2SO4含有2mol氢原子,4mol氧原子,1mol硫原子;9.8gH2SO4的物质的量为:0.1mol,所以与0.2g氢气所含氢原子数相同,49gH2SO4的物质的量为0.5mol,与0.5×18=9g水含有相同的分子数,故答案为:2;4;1;0.2;9.
点评 本题考查了物质的量、微粒个数的计算,明确分子和原子的关系是解本题关键,难度不大.

练习册系列答案
相关题目
8.下列说法不正确的是( )
| A. | 可以用丁达尔现象区分溶液和胶体 | |
| B. | 硅是良好的半导体材料,纯净二氧化硅是光导制品的基本原料 | |
| C. | SO2 使高锰酸钾褪色是利用 SO2 的漂白性 | |
| D. | 定容时俯视刻度线,会导致浓度偏高 |
6.工业上可由乙苯生产苯乙烯: $→_{△}^{Fe_{2}O_{3}}$
$→_{△}^{Fe_{2}O_{3}}$ +H2,下列说法正确的是( )
+H2,下列说法正确的是( )
 $→_{△}^{Fe_{2}O_{3}}$
$→_{△}^{Fe_{2}O_{3}}$ +H2,下列说法正确的是( )
+H2,下列说法正确的是( )| A. | 乙苯苯环上的一氯取代物有三种 | |
| B. | 1mol苯乙烯分别与足量的溴水或氢气反应最多消耗Br2或H24mol | |
| C. | 乙苯分子中共平面的碳原子最多只有7个 | |
| D. | 该反应为还原反应 |
13.分子式为C5H10,且分子中含有2个甲基的烯烃共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
4.提纯少量含碳酸氢钠杂质的碳酸钠固体所需用的仪器是( )
①试管;②泥三角;③蒸发皿;④试管夹;⑤坩埚;⑥玻璃棒;⑦石棉网;⑧坩埚钳.
①试管;②泥三角;③蒸发皿;④试管夹;⑤坩埚;⑥玻璃棒;⑦石棉网;⑧坩埚钳.
| A. | ①②④ | B. | ②⑤⑧ | C. | ③⑧⑥ | D. | ⑥⑦ |
1.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 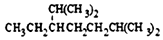 2,6-二甲基-5-乙基庚烷 | B. | 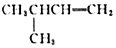 3-甲基-1-丁烯 | ||
| C. | 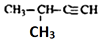 2-甲基-3-丁烯 | D. | 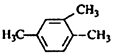 1,3,4-三甲苯 |
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.lmolC2H6O分子中含C-H键数目为0.5NA | |
| B. | 1L1mol•L-1的NH4Cl溶液中含有NH4+数目为0.1NA | |
| C. | 8.4gNaHCO3和MgCO3混合物中含有阴离子数目为0.1NA | |
| D. | 标准状况下,2.24LCl2与过量NaOH溶液反应转移电子数为0.2NA |
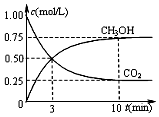 燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.
燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.