题目内容
10.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 常温常压下,2.24LH2O中分子的数目为0.1NA | |
| B. | 0.1mol•L-1NH4Cl溶液中含有Cl-的数目为0.1NA | |
| C. | 常温下,1.7gNH3中含有氢原子数目为0.3 NA | |
| D. | 5.6g铁粉在足量的氯气中充分燃烧,转移电子数为0.2NA |
分析 A、常温常压下水为液态;
B、溶液体积不明确;
C、求出氨气的物质的量,然后根据氨气中含3个氢原子来分析;
D、求出铁的物质的量,然后根据铁在氯气中燃烧变为+3价来分析.
解答 解:A、常温常压下水为液态,故不能根据气体摩尔体积来计算其物质的量和水分子个数,故A错误;
B、溶液体积不明确,故溶液中的氯离子的个数无法计算,故B错误;
C、1.7g氨气的物质的量为0.1mol,而氨气中含3个氢原子,故0.1mol氨气中含0.3NA个氢原子,故C正确;
D、5.6g铁的物质的量为0.1mol,而铁在氯气中燃烧变为+3价,故0.1mol铁燃烧后转移0.3NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20. 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:
(1)D的元素符号为Ca.14gA的单质分子中π键的个数为6.02×1023 .
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是水分子之间形成氢键.
(3)A、B、C 3种元素的电负性由大到小的顺序为F>N>O(用元素符号表示).
(4)E2+的价层电子排布图为 .
.
(5)A的最简单氢化物分子的空间构型为三角锥形,其中A原子的杂化类型是sp3杂化.
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,求晶胞边长a=$\root{3}{\frac{4×78}{ρ{N}_{A}}}$cm.(用ρ、NA的计算式表示)
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| A | 基态原子2p能级有3个单电子 |
| B | 基态原子p轨道上成对电子数等于未成对电子数 |
| C | 氢化物常用于刻蚀玻璃 |
| D | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| E | 原子序数等于C与D的原子序数之和 |
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是水分子之间形成氢键.
(3)A、B、C 3种元素的电负性由大到小的顺序为F>N>O(用元素符号表示).
(4)E2+的价层电子排布图为
 .
.(5)A的最简单氢化物分子的空间构型为三角锥形,其中A原子的杂化类型是sp3杂化.
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,求晶胞边长a=$\root{3}{\frac{4×78}{ρ{N}_{A}}}$cm.(用ρ、NA的计算式表示)
1.酸雨中存在电离平衡:H2S03?H++HSO${\;}_{3}^{-}$和HSO${\;}_{3}^{-}$?H++S032-,下列说法正确的是( )
| A. | 若向H2SO3,溶液中加入氯化钙溶液,平衡向右移动,会产生亚硫酸钙沉淀. | |
| B. | 若向H2S03溶液巾加人氢氧化钠溶液,平衡向右移动,pH变大 | |
| C. | 适当升溫(假如亚硫酸不分解不挥发),平衡向左移动,电离平衡常数减小 | |
| D. | 25℃时,笫一步电离常数K,小于第二步电离常数K2 |
15.下列混合物的分离方法不可行的是( )
| A. | 互溶的液态混合物可用分液的方法分离 | |
| B. | 互不相溶的液态混合物可用分液的方法分离 | |
| C. | 沸点不同的液态混合物可用蒸馏的方法分离 | |
| D. | 氯化钠和氧化铜形成的混合物可以按溶解、过滤、蒸发的顺序分离 |
2.常温下,某溶液 A 中含有 NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、Cl-、SO42-、SO32-,现取该溶液进行有关实验,实验结果如图所示

下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 沉淀乙一定可溶于盐酸 | |
| B. | 溶液中一定存在 Na+、Al3+,一定没有 Fe3+、Fe2+、CO32- | |
| C. | 溶液中一定有 SO42-,可能有 K+、Cl- | |
| D. | 气体甲、乙均为无色、有刺激性气味 |
19.下列属于取代反应的是( )
| A. | 甲烷的燃烧 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍做催化剂的条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
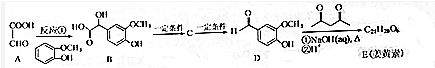
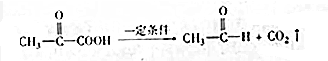


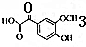
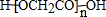
 ,
,