题目内容
某同学设计如下实验方案,分离KCl和BaCl2两种固体混合物.
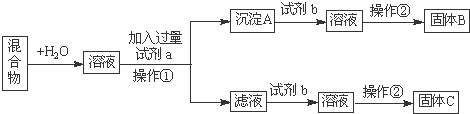
试回答下列问题:
(1)试剂a是 ;试剂b是 ;固体B是 .(填化学式)
(2)操作②的名称是: 、 、干燥.
(3)加入试剂a所发生的离子方程式为: .沉淀A与试剂b所发生的离子方程式为: .

试回答下列问题:
(1)试剂a是
(2)操作②的名称是:
(3)加入试剂a所发生的离子方程式为:
考点:物质分离和提纯的方法和基本操作综合应用,物质分离、提纯的实验方案设计
专题:实验设计题
分析:分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl.
解答:
解:(1)由流程可知,溶解后加试剂a为K2CO3,操作①为过滤,沉淀A为碳酸钡,试剂b为HCl,得到氯化钡溶液,操作②为蒸发、结晶得到固体B为氯化钡,
故答案为:K2CO3;HCl;BaCl2;
(2)由溶液得到固体B可知,操作②为蒸发、结晶、干燥等,故答案为:蒸发;结晶;
(3)加入试剂a,K2CO3与BaCl2反应生成BaCO3沉淀,发生的离子方程式为CO32-+Ba2+=BaCO3↓,
加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:CO32-+Ba2+=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O.
故答案为:K2CO3;HCl;BaCl2;
(2)由溶液得到固体B可知,操作②为蒸发、结晶、干燥等,故答案为:蒸发;结晶;
(3)加入试剂a,K2CO3与BaCl2反应生成BaCO3沉淀,发生的离子方程式为CO32-+Ba2+=BaCO3↓,
加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:CO32-+Ba2+=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O.
点评:本题考查物质分离提纯的方法和综合应用,为高频考点,把握流程中物质的性质及发生的反应为解答的关键,侧重分析、实验能力的考查,题目难度中等.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
在50mL 0.01mol?L-1下列溶液中,溶解CaCO3质量最大的是( )
| A、Na2CO3溶液 |
| B、NaOH溶液 |
| C、NH4Cl溶液 |
| D、NaHCO3溶液 |
已知常温下:KSP (AgCl)=1.8×10-10 mol2?L-2,KSP (Ag2CrO4)=1.9×10-12 mol3?L-3,下列叙述正确的是( )
| A、AgCl在饱和NaCl溶液中的 KSP比在纯水中的 KSP 小 |
| B、向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP (AgCl)<KSP (AgI) |
| C、将0.001 mol?L-1 的AgNO3溶液滴入0.001 mol?L-1 的KCl和0.001 mol?L-1 的K2CrO4 溶液中先产生Ag2CrO4沉淀 |
| D、向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
下列关于有机物的说法中,不正确的是( )
| A、棉花、蚕丝和锦纶的主要成分都是纤维素 |
| B、苯、乙醇和乙酸都能发生取代反应 |
| C、将铜片在酒精灯上加热变黑后迅速插入乙醇溶液中,铜片恢复红色且质量不变 |
| D、用新制的Cu ( OH )2可用于检验尿液中的葡萄糖 |
 将镁、铝的混合物0.1mol 溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示,计算:(1)当a=160mL时,金属混合物中n(Mg)=
将镁、铝的混合物0.1mol 溶于100mL 2mol/L H2SO4溶液中,然后再滴加1mol/L 的NaOH溶液,沉淀质量m 随加入NaOH溶液的体积V 变化情况如图所示,计算:(1)当a=160mL时,金属混合物中n(Mg)=