题目内容
硫化银被铁粉还原应在 (填设备名称)中进行.
考点:铁的化学性质,常见金属的活动性顺序及其应用
专题:元素及其化合物
分析:硫化银被铁粉还原,发生Ag2S+Fe+2HCl
H2S↑+2Ag+FeCl2,H2S有毒,以此来解答.
| ||
解答:
解:硫化银被铁粉还原,发生Ag2S+Fe+2HCl
H2S↑+2Ag+FeCl2,H2S有毒,该反应需要在通风橱中进行,多余的尾气需要碱液吸收,不能直接排放在环境中污染空气,
故答案为:通风橱.
| ||
故答案为:通风橱.
点评:本题考查物质的性质及实验安全,为高频考点,把握发生的反应及硫化氢的毒性为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
关于金刚石、石墨和C60的判断,正确的是( )
| A、均含共价键 |
| B、互为同分异构体 |
| C、互为同位素 |
| D、性质相同 |
还原沉淀法是处理含铬(含Cr2072-和CrO42-)工业废水的常用方法,过程如下:CrO
Cr2O
Cr 3+
Cr(OH)3↓已知转化过程中的反应为:2CrO
(aq)+2H+ (aq)?Cr2O
(aq)+H2O(l).转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有
转化为Cr2072-,下列说法不正确的是( )
2- 4 |
| H+ |
| 转换 |
2- 7 |
| Fe2+ |
| 还原 |
| OH- |
| 沉淀 |
2- 4 |
2- 7 |
| 10 |
| 11 |
| A、溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B、若用绿矾(FeS04?7H20)(M=278)作还原剂,处理1 L废水,至少需要917.4 g |
| C、常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6 |
| D、常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
在下列条件下能制得括号中物质的是( )
A、苯在常温下与浓硝酸混合(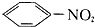 ) ) |
| B、将乙烯通入到水中(CH3CH2OH) |
C、甲苯与氯气在氯化铁催化下反应( ) ) |
| D、乙醇在银催化下加热与氧气反应(CH3CHO) |
有关AgCl沉淀的溶解平衡说法正确的是( )
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度减小 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀不变 |
把NaHCO3和Na2CO3.10H2O混合6.56克溶于水,制成100ml溶液,其中Na+物质的量浓度为0.5mol/L,若将等质量的该混合物加热至恒重,所得固体质量为( )
| A、2.65 g |
| B、3.91 g |
| C、5.3 g |
| D、4.23g |
 某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6mol?L-1,下列结论正确的是( )
某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1反应过程中B、A的浓度比与时间t有如图所示关系,若测得第15min时c(B)=1.6mol?L-1,下列结论正确的是( )| A、该温度下此反应的平衡常数为3.2 |
| B、A的初始物质的量为4 mol |
| C、反应到达平衡时,放出的热量是193kJ |
| D、反应达平衡时,A的转化率为80% |