题目内容
6.下列条件一定能使反应速率增大的是( )①增加反应物的物质的量入
②升高温度
③缩小反应容器的体积
④不断分离出生成物
⑤加入MnO2.
| A. | 全部 | B. | ①②⑤ | C. | ②③ | D. | ② |
分析 一般来说,增大浓度、温度、压强、加入催化剂,增大固体表面积等,可增大反应速率,以此解答该题.
解答 解:①如果反应物是固体,增加固体反应物的物质的量,反应速率不变,故①错误;
②由于温度升高,增大活化分子百分数,反应速率一定加快,故②正确;
③缩小反应容器的体积,如没有气体参加,则反应物浓度不变,反应速率不变,故③错误;
④不断分离出生成物可导致生成物浓度降低,反应速率减小,故④错误;
⑤MnO2不为所有反应的催化剂有加快反应速率的,反应速率不一定加快,故⑤错误;
故选D.
点评 本题考查影响化学反应速率的常见因素,较简单,为高频考点,侧重于学生的分析能力的考查,反应中固体、纯液体的量发生改变对反应速率无影响是学生在解题中容易忽略的知识.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
4.常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )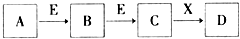
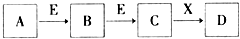
| A. | 若E为Fe,X是氢氧化钠,则A一定是氯气 | |
| B. | 若A为S,X为水,则A、B、C、D均可与氢氧化钠反应 | |
| C. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| D. | 若C是红棕色的气体,则A既可以是单质,也可以是化合物 |
11.对于可逆反应3H2+N2?2NH3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
| A. | 使用高效催化剂 | B. | 充入更多N2 | C. | 降低温度 | D. | 增大压强 |
18.将浓度为0.2rnol•LNH3•H2O溶液加水不断稀释,下列各量增大的是( )
| A. | c(H+) | B. | Kb(NH3•H2O) | ||
| C. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$ | D. | c(NH4+) |
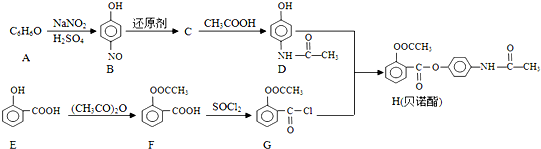
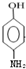 ;
;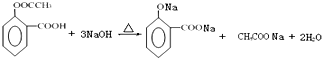 ;
;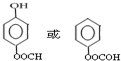 ;
;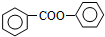 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):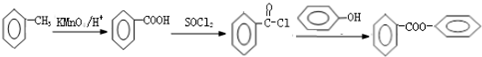 .
.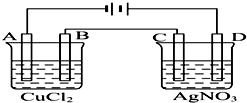 如图为以惰性电极进行电解的装置:
如图为以惰性电极进行电解的装置:
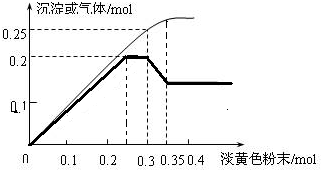 图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答:
图象分析是化学研究的一种重要的手段.某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出).请回答: