题目内容
已知:NO3-+4H++3e-→NO+2H2O.KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中有一种(甲)能使上述还原过程发生.
(1)写出并配平该氧化还原反应的化学反应方程式: .
(2)反应中硝酸体现了 、 性质.
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
(4)N 有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,且只生成一种C的含氧酸盐,该含氧酸盐的化学式为 .
(1)写出并配平该氧化还原反应的化学反应方程式:
(2)反应中硝酸体现了
(3)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
(4)N 有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,且只生成一种C的含氧酸盐,该含氧酸盐的化学式为
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)还原过程中N元素的化合价降低,则应与还原剂Cu2O发生氧化还原反应,再根据电子守恒及质量守恒定律来配平化学反应方程式;
(2)反应生成硝酸铜、NO,生成硝酸盐体现酸性,生成NO时N元素的化合价降低;
(3)根据浓硝酸被还原的产物及氧化还原反应来分析原因;
(4)该无色气体为NO,与氧气反应的体积比为4:1,结合得失电子守恒计算.
(2)反应生成硝酸铜、NO,生成硝酸盐体现酸性,生成NO时N元素的化合价降低;
(3)根据浓硝酸被还原的产物及氧化还原反应来分析原因;
(4)该无色气体为NO,与氧气反应的体积比为4:1,结合得失电子守恒计算.
解答:
解:(1)KMnO4、Na2CO3、Fe2(SO4)3中Mn、C、Fe元素都处在最高价,则具有氧化性,只有Cu2O中Cu处在较低价,则具有还原性,在NO3-+4H++3e→NO+2H2O中发生的氧化剂被还原的反应,则该氧化还原反应为Cu2O+HNO3→NO↑+Cu(NO3)2+H2O,Cu元素由+1价升高到+2价,N元素由+5价降低到+2价,由电子守恒及质量守恒定律,配平的化学反应为3Cu2O+14HNO3═2NO↑+6Cu(NO3)2+7H2O,
故答案为:3Cu2O+14HNO3═2NO↑+6Cu(NO3)2+7H2O;
(2)因硝酸中的N元素的化合价为+5价,NO中N元素的化合价为+2价,在该反应中N元素的化合价降低,则体现硝酸的氧化性,而硝酸与硝酸中N元素的化合价相同,则体现硝酸具有酸性,故答案为:氧化性;酸性;
(3)Cu2O+6HNO3(浓)═2Cu(NO3)2+2NO2↑+3H2O …①,
14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O …②,
将②式子系数除以3得到
HNO3+Cu2O═2Cu(NO3)2+
NO↑+
H2O,
可知用稀硝酸氧化1molCu2O需要
mol硝酸作氧化剂,用浓硝酸需要2mol硝酸作氧化剂,质量当然增加,
故答案为:使用浓硝酸,产物中有NO2生成;
(4)该无色气体为NO,与氧气反应的体积比为4:1,设反应后N元素化合价为+x,则4×(x-2)=1×4,x=3,所以产物为NaNO2,
故答案为:NaNO2.
故答案为:3Cu2O+14HNO3═2NO↑+6Cu(NO3)2+7H2O;
(2)因硝酸中的N元素的化合价为+5价,NO中N元素的化合价为+2价,在该反应中N元素的化合价降低,则体现硝酸的氧化性,而硝酸与硝酸中N元素的化合价相同,则体现硝酸具有酸性,故答案为:氧化性;酸性;
(3)Cu2O+6HNO3(浓)═2Cu(NO3)2+2NO2↑+3H2O …①,
14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O …②,
将②式子系数除以3得到
| 14 |
| 3 |
| 2 |
| 3 |
| 7 |
| 3 |
可知用稀硝酸氧化1molCu2O需要
| 2 |
| 3 |
故答案为:使用浓硝酸,产物中有NO2生成;
(4)该无色气体为NO,与氧气反应的体积比为4:1,设反应后N元素化合价为+x,则4×(x-2)=1×4,x=3,所以产物为NaNO2,
故答案为:NaNO2.
点评:本题考查氧化还原反应,为高考常见题型,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念和转移电子数的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列除杂质的操作方法正确的是( )
| A、SO2中有少量的HCl:通过亚硫酸钠溶液 |
| B、碘晶体中有少量的NH4Cl:通过加热的方法 |
| C、NO中有少量的NO2:用水洗涤后再干燥 |
| D、Cl2中有少量的HCl:通过烧碱溶液 |
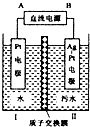 如图所示是利用电化学降解法治理水中的硝酸盐污染,电解槽中间用质子交换膜隔开,污水放入II区,通电使转NO3-化为N2,下面说法不正确的是( )
如图所示是利用电化学降解法治理水中的硝酸盐污染,电解槽中间用质子交换膜隔开,污水放入II区,通电使转NO3-化为N2,下面说法不正确的是( )| A、电解时H+从I区通过离子交换膜迁移到II区 |
| B、Ag-Pt电极上发生发应:2NO3-+10e-+6H2O═N2↑+12OH- |
| C、当电解过程中转移了1moL电子,则II区电解液质量减少2.8g |
| D、为增强溶液的导电性,I区水中可加入少量Na2SO4固体 |
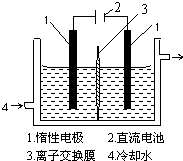 在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.
在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.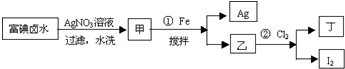
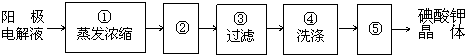
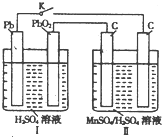 高锰酸钾和二氧化锰是中学化学常用的化学试剂.根据下面相关的信息回答下列问题:
高锰酸钾和二氧化锰是中学化学常用的化学试剂.根据下面相关的信息回答下列问题: i.
i. j.
j. k.
k.