题目内容
下列离子方程式正确的是( )
| A、将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:Al3++2SO42-+3OH-+2Ba2+=2BaSO4↓+Al(OH)3↓ |
| B、KMnO4与浓盐酸反应制Cl2:2MnO4-+16HCl=2Mn2++6Cl-+5Cl2↑+8H2O |
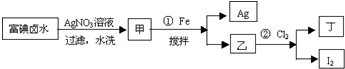
| C、0.1 mol Cl2和100 mL 1 mol/L FeBr2反应:3Cl2+2Fe2++4Br -=6Cl-+2Fe3++2Br2 |
| D、用Al(OH)3中和过多的胃酸:Al(OH)3+3H+=Al3++3H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、沉淀的质量恰好最大,即钡离子和硫酸离子恰好完全沉淀;
B、盐酸是强电解质,应写成离子的形式;
C、首先是还原性强的亚铁离子先反应,后溴离子反应;
D、胃酸的主要成份是盐酸,强电解质,而Al(OH)3是弱电解质应写成化学式.
B、盐酸是强电解质,应写成离子的形式;
C、首先是还原性强的亚铁离子先反应,后溴离子反应;
D、胃酸的主要成份是盐酸,强电解质,而Al(OH)3是弱电解质应写成化学式.
解答:
解:A、沉淀的质量恰好最大,即钡离子和硫酸离子恰好完全沉淀,设KAl(SO4)2为1mol,则电离产生2mol的SO42-,恰好完全沉淀需要2mol的氢氧化钡,2mol的氢氧化钡电离产生4mol的氢氧根离子与1molKAl(SO4)2电离出的铝离子恰好完全反应,生成偏铝酸根离子,正确的离子方程式为Al3++2SO42-+4OH-+2Ba2+=2BaSO4↓+AlO2-+2H2O,故A错误;
B、盐酸是强电解质,应写成离子的形式,正确的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故B错误;
C、0.1 mol Cl2的得到0.2mol的电子,0.1mol的亚铁离子失去0.1mol的电子,还有0.1mol是溴离子提供电子,所以亚铁离子和溴离子之比为1:1,离子方程式为2Cl2+2Fe2++2Br -=4Cl-+2Fe3++Br2,故C错误;
D、胃酸的主要成份是盐酸,强电解质,而Al(OH)3是弱电解质应写成化学式,离子方程式为Al(OH)3+3H+=Al3++3H2O,故D正确;
故选D.
B、盐酸是强电解质,应写成离子的形式,正确的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,故B错误;
C、0.1 mol Cl2的得到0.2mol的电子,0.1mol的亚铁离子失去0.1mol的电子,还有0.1mol是溴离子提供电子,所以亚铁离子和溴离子之比为1:1,离子方程式为2Cl2+2Fe2++2Br -=4Cl-+2Fe3++Br2,故C错误;
D、胃酸的主要成份是盐酸,强电解质,而Al(OH)3是弱电解质应写成化学式,离子方程式为Al(OH)3+3H+=Al3++3H2O,故D正确;
故选D.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
相关题目
已知:氧化性Fe3+>Cu2+,向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A、溶液中一定含有 Fe3+ |
| B、溶液中一定含Fe2+ |
| C、溶液中一可能含有Cu2+ |
| D、剩余固体中一定含铜 |
下列有关实验操作的叙述中,正确的是( )


| A、可用右图所示的方法将烧杯中的溶液转移到容量瓶中 |
| B、容量瓶可用于配制溶液,但不能作为反应容器使用 |
| C、稀释浓硫酸时,先向烧杯中注入浓硫酸,再加水稀释 |
| D、用托盘天平称量NaOH固体时,需将NaOH固体放在托盘上的纸上 |
下列物质之间的反应因反应条件不同或反应用量不同,而产物不发生改变的是( )
| A、钠与氧气反应 |
| B、铁在氯气中燃烧 |
| C、氯化铝溶液与氢氧化钠溶液 |
| D、二氧化碳与氢氧化钙溶液 |
下列叙述正确的是( )
| A、只有在标准状况下,48 g O3气体才含有6.02×1023个O3分子 |
| B、常温常压下,4.6 gNO2气体约含有1.81×1023个原子 |
| C、0.5 mol?L-1CuCl2溶液中含有Cu2+数小于3.01×1023个 |
| D、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
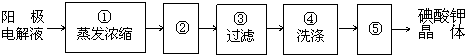
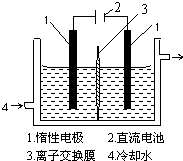 在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.
在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.