题目内容
5.为比较温室效应气体对全球增温现象的影响,科学家以CO2为相对标准,引入了“温室效应指数”的概念(如下表).| 物质 | 大气中的含量 (体积百分比) | 温室效应 指数 |
| CO2 | 0.03 | 1 |
| H2O | 1 | 0.1 |
| CH4 | 2×10-4 | 30 |
| N2O4 | 3×10-5 | 160 |
| O3 | 4×10-6 | 2000 |
| CCl2F2 | 4.8×10-8 | 25000 |
(1)6种气体中,温室效应指数最大的物质属于极性分子(选填“极性分子”或“非极性分子”).
(2)1mol CO2中σ键的数目为2NA,由第二周期原子构成与CO2互为等电子体的分子是N2O,阴离子是N3-.(写一种)
(3)水的沸点高于CO2的原因是水分子间含氢键,冰熔化时体积变小密度变大的原因是晶体结构被破坏,使分子间隙减小.
(4)配合物Fe (CO)5结构式如图:
 配合物中碳原子的轨道杂化类型是sp杂化;1mol Fe (CO)5分子中含有σ键的数目为10NA.
配合物中碳原子的轨道杂化类型是sp杂化;1mol Fe (CO)5分子中含有σ键的数目为10NA.
分析 (1)由“温室效应指数”可知,CCl2F2最大,为四面体结构,不对称;
(2)CO2结构式为O=C=O,双键中含1个σ键;原子数、价电子数相同的为等电子体;
(3)水分子间含氢键;冰熔化时体积变小密度变大,与结构有关;
(4)配合物中碳原子不存在孤对电子,σ键数为2,Fe (CO)5分子含10个σ键.
解答 解:(1)由“温室效应指数”可知,CCl2F2最大,为四面体结构,不对称,为极性分子,故答案为:极性分子;
(2)CO2结构式为O=C=O,双键中含1个σ键,1mol CO2中σ键的数目为2NA;原子数、价电子数相同的为等电子体,则由第二周期原子构成与CO2互为等电子体的分子是N2O,阴离子是N3-,
故答案为:2NA;N2O;N3-;
(3)水的沸点高于CO2的原因是水分子间含氢键,冰熔化时体积变小密度变大的原因是晶体结构被破坏,使分子间隙减小,质量不变,体积变小,而密度增大,
故答案为:水分子间含氢键;晶体结构被破坏,使分子间隙减小;
(4)配合物中碳原子不存在孤对电子,σ键数为2,Fe (CO)5分子含10个σ键,则配合物中碳原子的轨道杂化类型是sp杂化;1mol Fe (CO)5分子中含有σ键的数目为10NA,故答案为:sp杂化;10NA.
点评 本题考查杂化理论及分子结构等,为高频考点,把握习题中的信息、分子结构、杂化理论为解答的关键,侧重分析与应用能力的考查,注意氢键的分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列离子方程式书写正确的是( )
| A. | 碳酸钙中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸钠溶液中加入氢氧化铜:Cu2++CO32-═CuCO3↓ | |
| D. | 澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
10.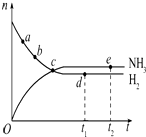 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大 |
17.体积完全相同的两个容器A和B,已知A装有SO2和O2各1g,B装有SO2和O2各2g,在相同温度下反应达到平衡时A中SO2的浓度a,B中SO2的浓度b,则A,B两容器中SO2浓度的关系正确的是( )
| A. | a=b | B. | a<b<2a | C. | 2a=b | D. | 2a<b |
15.已知反应:
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1;
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列结论正确的是( )
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1;
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列结论正确的是( )
| A. | .碳的燃烧热△H=-110.5 kJ•mol-1 | |
| B. | .①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| D. | .碳的燃烧热大于110.5 kJ•mol-1 |
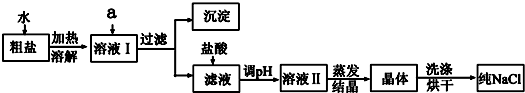
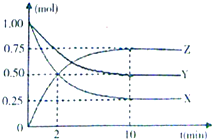 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示. (1)良好的生态环境可以提升生活质量.
(1)良好的生态环境可以提升生活质量.