题目内容
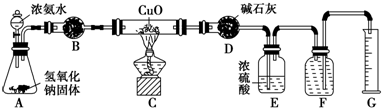 氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:
氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:(1)写出氨气与灼热氧化铜反应的方程式:
(2)在锥形瓶A中放入NaOH固体的目的是
(3)在干燥管B中能选用的干燥剂是
A.碱石灰 B.氯化钙固体 C.五氧化二磷 D.生石灰
(4)E装置中盛装浓硫酸的目的是
(5)待实验完毕后,若实验测得N2的体积(折算成标准状况)a L,干燥管D增重b g,则氨分子中氮、氢的原子个数比为
考点:氨的制取和性质
专题:实验题
分析:(1)氨气与灼热的氧化铜反应生成铜、氮气和水,依据质量守恒书写反应的化学方程式;
(2)根据氢氧化钠能够电离出氢氧根离子、氢氧化钠溶于水放出热量等方面分析;
(3)氨气为碱性气体,不能用酸性干燥剂干燥;
(4)浓硫酸能够吸收未反应的氨气,还能够防止F中水分进入D;
(5)根据n=
计算出氮气的物质的量,再根据反应方程式2NH3+3CuO
N2+3Cu+3H2O计算出被还原的氧化铜的物质的量;根据n=
计算出反应生成水的物质的量,再根据质量守恒定律计算出N、H原子数之比;根据测定的反应生成水的质量偏大分析对测定氨分子组成的N、H原子个数的比值的影响.
(2)根据氢氧化钠能够电离出氢氧根离子、氢氧化钠溶于水放出热量等方面分析;
(3)氨气为碱性气体,不能用酸性干燥剂干燥;
(4)浓硫酸能够吸收未反应的氨气,还能够防止F中水分进入D;
(5)根据n=
| V |
| Vm |
| ||
| m |
| n |
解答:
解:(10氨气与灼热的氧化铜反应生成铜、氮气和水,反应的化学方程式为:2NH3+3CuO
N2+3Cu+3H2O;
故答案为:2NH3+3CuO
N2+3Cu+3H2O;
(2)浓氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-,氢氧化钠在溶液中电离出氢氧根离子,有利于氨气的生成;且氢氧化钠溶于水放出热量,降低了氨气的溶解度,
故答案为:利用NaOH的碱性和遇水放热的性质,使NH3?H2O分解生成NH3后逸出;
(3)无水硫酸铜只能用于检验水的存在,不能用于干燥氨气;五氧化二磷、无水氯化钙能够与氨气反应,不能干燥氨气,所以装置BD中盛放的是碱石灰,所以A正确,
故答案为:A;
(4)浓硫酸能够将反应剩余的氨吸收,防止F中的水蒸气进入D中,引起测量误差,
故答案为:吸收多余的NH3,防止F中的水蒸气进入D中;
(5)标准状况下,aL氮气的物质的量为:n(N2)=
=
mol,根据反应2NH3+3CuO
N2+3Cu+3H2O可知,被还原的CuO的物质的量为:n(CuO)=3n(N2)=
mol×3=
mol;
装置D增重的为水的质量,则水的物质的量为:
=
mol,含有的H的物质的量为:
mol×2=
mol,
氨气中含有的N、H原子数之比为:(
mol×2):
mol=
,
因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加,则测定氨分子组成的N、H原子个数的比值将会减小,
故答案为:
;减小.
| ||
故答案为:2NH3+3CuO
| ||
(2)浓氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-,氢氧化钠在溶液中电离出氢氧根离子,有利于氨气的生成;且氢氧化钠溶于水放出热量,降低了氨气的溶解度,
故答案为:利用NaOH的碱性和遇水放热的性质,使NH3?H2O分解生成NH3后逸出;
(3)无水硫酸铜只能用于检验水的存在,不能用于干燥氨气;五氧化二磷、无水氯化钙能够与氨气反应,不能干燥氨气,所以装置BD中盛放的是碱石灰,所以A正确,
故答案为:A;
(4)浓硫酸能够将反应剩余的氨吸收,防止F中的水蒸气进入D中,引起测量误差,
故答案为:吸收多余的NH3,防止F中的水蒸气进入D中;
(5)标准状况下,aL氮气的物质的量为:n(N2)=
| aL |
| 22.4L/mol |
| a |
| 22.4 |
| ||
| a |
| 22.4 |
| 3a |
| 22.4 |
装置D增重的为水的质量,则水的物质的量为:
| bg |
| 18g/mol |
| b |
| 18 |
| b |
| 18 |
| b |
| 9 |
氨气中含有的N、H原子数之比为:(
| a |
| 22.4 |
| b |
| 9 |
| 9a |
| 11.2b |
因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加,则测定氨分子组成的N、H原子个数的比值将会减小,
故答案为:
| 9a |
| 11.2b |
点评:本题考查了氨气的制法及化学性质,题目难度中等,注意掌握制取氨气的反应原理、氨气的化学性质,明确实验测定原理为解答本题的关键,(5)为易错点,需要明确装置BD的作用.

练习册系列答案
相关题目
将一定量的锌与100mL 18.5mol?L-1浓硫酸充分反应后,锌完全溶解,同时生成气体A 16.8L(标准状况).将反应后的溶液稀释到1L,测得溶液的pH=0,则下列叙述中错误的是( )
| A、气体A为SO2和H2的混合物 |
| B、气体A中SO2和H2的体积比为4:1 |
| C、反应中共消耗锌97.5 g |
| D、反应中共转移电子1.5 mol |
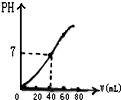 用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A、1.0mol?L-1、60mL |
| B、0.5mol?L-1、80mL |
| C、0.5mol?L-1、40mL |
| D、1.0mol?L-1、80mL |
 的名称
的名称 与足量浓Br2水充分反应:
与足量浓Br2水充分反应:
 铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.


 .请设计以
.请设计以 和
和 为原料合成化合物
为原料合成化合物 的实验方案.(用合成路线流程图表示为:A
的实验方案.(用合成路线流程图表示为:A