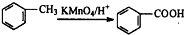题目内容
设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A、常温常压下,8 g甲烷(CH4)中含有的碳原子数为2NA |
| B、标准状况下,0.3 mol CO2中含氧原子数为0.3NA |
| C、1 mol Na与足量水反应后转移的电子数为NA |
| D、1 mol?L-1MgCl2溶液中Cl一离子数为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.依据n=
计算物质的量结合甲烷分子式计算碳原子数;
B.1个CO2中含氧原子数3个;
C.1mol Na与足量水反应,生成1molNa+电子转移依据反应的钠计算;
D.溶液的体积未知,无法计算.
| m |
| M |
B.1个CO2中含氧原子数3个;
C.1mol Na与足量水反应,生成1molNa+电子转移依据反应的钠计算;
D.溶液的体积未知,无法计算.
解答:
解:A.8g甲烷(CH4)物质的量=
=0.5mol,含有的碳原子数为0.5NA,故A错误;
B.1个CO2中含氧原子数3个,0.3 mol CO2中含氧原子数为0.3×2×NA=0.6NA,故B错误;
C.1mol Na与足量水反应后,生成1molNa+,转移的电子数依据反应的钠计算为NA ,故C正确;
D.要求Cl一离子数目,应知道溶液的体积,溶液的体积未知,无法计算,故D错误;
故选:C.
| 8g |
| 16g/mol |
B.1个CO2中含氧原子数3个,0.3 mol CO2中含氧原子数为0.3×2×NA=0.6NA,故B错误;
C.1mol Na与足量水反应后,生成1molNa+,转移的电子数依据反应的钠计算为NA ,故C正确;
D.要求Cl一离子数目,应知道溶液的体积,溶液的体积未知,无法计算,故D错误;
故选:C.
点评:本题考查了阿伏伽德罗常数计算及应用,主要侧重考查气体摩尔体积的条件应用,氧化还原反应电子转移计算,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
在铜-锌-硫酸构成的原电池中,经过一段时间的工作后,下列说法正确的是( )
| A、锌片是负极,铜片上有气泡冒出 |
| B、电流方向是从锌片流向铜片 |
| C、溶液中硫酸的物质的量不变 |
| D、电解液的pH保持不变 |
已知热化学方程式:SO2(g)+
O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
| 1 |
| 2 |
| A、等于196.64kJ?mol-1 |
| B、等于196.64 kJ |
| C、小于196.64kJ |
| D、大于196.64kJ |
下列说法正确的是( )
| A、在常温常压下,11.2LN2含有分子数为0.5NA |
| B、在常温常压下,22.4LNe含有原子数为NA |
| C、71gCl2所含有的原子数为2NA |
| D、在同温同压下,相同体积的气体单质含有原子数相同 |
1953年日本水俣湾发生了一起重大的中毒事件,造成人畜大量死亡.科学家分析发现,水俣湾鱼体内甲基汞的含量比周围水体内的甲基汞含量高3000倍,那么甲基汞进入鱼体内的主要方式是 ( )
| A、主动运输 |
| B、渗透作用 |
| C、鳃部交换气体随血液循环 |
| D、水中食物链 |
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l) △H=-57.3KJ?mol-1
分别向1L 0.5mol?L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀醋酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
分别向1L 0.5mol?L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀醋酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
| A、△H1>△H3>△H2 |
| B、△H1<△H3<△H2 |
| C、△H1>△H2=△H3 |
| D、△H1=△H2<△H3 |