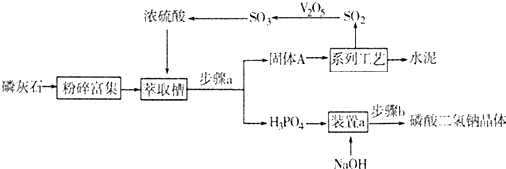
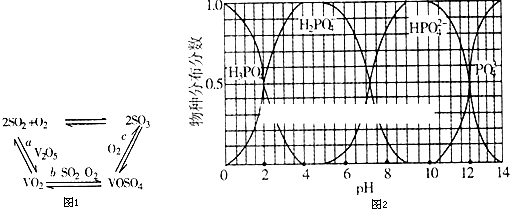
题目内容
密闭容器中mA(气)+nB(气)═pC(气)达平衡后,温度一定时,将气体体积压缩到原来的一半,当重新达平衡时,C的浓度为原来的1.9倍,则m+n p (填大小关系).
考点:化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到一半,若平衡不移动,C的浓度为原来的2倍,当达到平衡时C的浓度为原来的1.9倍,则体积减小时平衡逆向移动,以此来解答.
解答:
解:mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到一半,若平衡不移动,C的浓度为原来的2倍,当达到平衡时C的浓度为原来的1.9倍,则体积减小时平衡逆向移动,则m+n<p,
故答案为:<.
故答案为:<.
点评:本题考查影响平衡移动的因素,注意把握“体积压缩到一半,当达到平衡时C的浓度为原来的1.9倍”为解答的关键信息,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
饱和氯水久置后,溶液中的各种粒子:①Cl2 ②H2O ③Cl- ④HClO ⑤H+减少的是( )
| A、①②④ | B、①②③ |
| C、①④ | D、②④ |
298K下,将0.1molNaCl溶解在1L水中,此溶解过程中体系的△G=△H-T△S和△S的变化情况是( )
| A、△G>0,△S<0 |
| B、△G<0,△S>0 |
| C、△G>0,△S>0 |
| D、△G<0,△S<0 |
氨分解反应在容积为2L的密闭容器内进行.已知起始时氨气的物质的量为4mol,5秒末为2.4mol,则用氨气表示该反应的速率为( )
| A、0.32 mol?L-1?s-1 |
| B、0.16 mol?L-1?s-1 |
| C、1.6 mol?L-1?s-1 |
| D、0.8 mol?L-1?s-1 |
下列有关工业生产的叙述正确的是( )
| A、合成氨生产过程增大氮气浓度,可以同时提高N2、H2的转化率 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,阳极溶解的金属的质量与阴极析出的金属的质量不相等 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A、常温常压下,8 g甲烷(CH4)中含有的碳原子数为2NA |
| B、标准状况下,0.3 mol CO2中含氧原子数为0.3NA |
| C、1 mol Na与足量水反应后转移的电子数为NA |
| D、1 mol?L-1MgCl2溶液中Cl一离子数为0.2NA |
下列有关晶体的说法中正确的是( )
| A、某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 |
| B、原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 |
| C、区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 |
| D、任何晶体中,若含有阳离子也一定含有阴离子 |
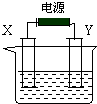 氯碱工业中电解饱和食盐水的原理示意图如图所示,X和Y均为电极石墨,电解液为滴有酚酞的饱和食盐水.
氯碱工业中电解饱和食盐水的原理示意图如图所示,X和Y均为电极石墨,电解液为滴有酚酞的饱和食盐水.