题目内容
在铜-锌-硫酸构成的原电池中,经过一段时间的工作后,下列说法正确的是( )
| A、锌片是负极,铜片上有气泡冒出 |
| B、电流方向是从锌片流向铜片 |
| C、溶液中硫酸的物质的量不变 |
| D、电解液的pH保持不变 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-=H2↑,原电池工作时,电子由负极经外电路流向正极,阳离子向正极移动,阴离子向负极移动,以此解答.
解答:
解:A.该装置中,锌易失电子作负极,铜作正极,发生还原反应,电极方程式为2H++2e-=H2↑,故A正确;
B.原电池工作时,电子由锌片经导线流向铜片,电流方向是从Cu片流向Zn片,故B错误;
C.反应消耗硫酸,则工作一段时间后溶液酸性减弱,硫酸的物质的量减小,故C错误;
D.反应消耗硫酸,则工作一段时间后溶液酸性减弱,pH增大,故D错误.
故选A.
B.原电池工作时,电子由锌片经导线流向铜片,电流方向是从Cu片流向Zn片,故B错误;
C.反应消耗硫酸,则工作一段时间后溶液酸性减弱,硫酸的物质的量减小,故C错误;
D.反应消耗硫酸,则工作一段时间后溶液酸性减弱,pH增大,故D错误.
故选A.
点评:本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理和电极方程式的书写,难度不大.

练习册系列答案
相关题目
25℃时,由水电离出的c(H+)=1×10-14 mol?L-1的溶液中,一定能大量共存的离子组是( )
| A、K+、ClO-、SO42-、HCOO- |
| B、Na+、K+、Cl-、NO3- |
| C、NH4+、Al3+、NO3-、Cl- |
| D、Fe2+、Cu2+、NO3-、SO42- |
下列物质的水溶液中,只有一种分子存在的是( )
| A、NaF |
| B、NaHCO3 |
| C、HClO |
| D、HNO3 |
饱和氯水久置后,溶液中的各种粒子:①Cl2 ②H2O ③Cl- ④HClO ⑤H+减少的是( )
| A、①②④ | B、①②③ |
| C、①④ | D、②④ |
设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A、常温常压下,8 g甲烷(CH4)中含有的碳原子数为2NA |
| B、标准状况下,0.3 mol CO2中含氧原子数为0.3NA |
| C、1 mol Na与足量水反应后转移的电子数为NA |
| D、1 mol?L-1MgCl2溶液中Cl一离子数为0.2NA |
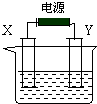 氯碱工业中电解饱和食盐水的原理示意图如图所示,X和Y均为电极石墨,电解液为滴有酚酞的饱和食盐水.
氯碱工业中电解饱和食盐水的原理示意图如图所示,X和Y均为电极石墨,电解液为滴有酚酞的饱和食盐水.