题目内容
已知热化学方程式:SO2(g)+
O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
| 1 |
| 2 |
| A、等于196.64kJ?mol-1 |
| B、等于196.64 kJ |
| C、小于196.64kJ |
| D、大于196.64kJ |
考点:化学反应的可逆性
专题:化学平衡专题
分析:根据热化学方程式得出生成1molSO3时放出的热量,利用极限法计算出2mol SO2和1molO2反应生成SO3的物质的量,计算放出的热量,由于可逆反应的不完全性,所以放出的热量小于按极限法计算放出的热量.
解答:
解:根据热化学方程式SO2(g)+
O2(g)  SO3(g)△H=-98.32kJ/mol的含义,可知SO2和O2反应生成1molSO3时放出的热量为98.32kJ,所以生成2molSO3时放出的热量为196.64kJ,由于是可逆反应,2mol SO2和1molO2不能完全反应,所以放出的热量小于196.64kJ.
SO3(g)△H=-98.32kJ/mol的含义,可知SO2和O2反应生成1molSO3时放出的热量为98.32kJ,所以生成2molSO3时放出的热量为196.64kJ,由于是可逆反应,2mol SO2和1molO2不能完全反应,所以放出的热量小于196.64kJ.
故选C.
| 1 |
| 2 |
 SO3(g)△H=-98.32kJ/mol的含义,可知SO2和O2反应生成1molSO3时放出的热量为98.32kJ,所以生成2molSO3时放出的热量为196.64kJ,由于是可逆反应,2mol SO2和1molO2不能完全反应,所以放出的热量小于196.64kJ.
SO3(g)△H=-98.32kJ/mol的含义,可知SO2和O2反应生成1molSO3时放出的热量为98.32kJ,所以生成2molSO3时放出的热量为196.64kJ,由于是可逆反应,2mol SO2和1molO2不能完全反应,所以放出的热量小于196.64kJ.故选C.
点评:以反应热的计算为载体,考查可逆反应的不完全性,注意可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物

练习册系列答案
相关题目
25℃时,由水电离出的c(H+)=1×10-14 mol?L-1的溶液中,一定能大量共存的离子组是( )
| A、K+、ClO-、SO42-、HCOO- |
| B、Na+、K+、Cl-、NO3- |
| C、NH4+、Al3+、NO3-、Cl- |
| D、Fe2+、Cu2+、NO3-、SO42- |
下列物质的水溶液中,只有一种分子存在的是( )
| A、NaF |
| B、NaHCO3 |
| C、HClO |
| D、HNO3 |
饱和氯水久置后,溶液中的各种粒子:①Cl2 ②H2O ③Cl- ④HClO ⑤H+减少的是( )
| A、①②④ | B、①②③ |
| C、①④ | D、②④ |
下列对分子性质的解释中,不正确的是( )
| A、碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
B、由于乳酸(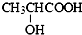 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 |
| C、HF的稳定性很强,是因为其分子间能形成氢键 |
D、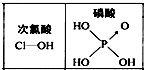 由图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子 |
298K下,将0.1molNaCl溶解在1L水中,此溶解过程中体系的△G=△H-T△S和△S的变化情况是( )
| A、△G>0,△S<0 |
| B、△G<0,△S>0 |
| C、△G>0,△S>0 |
| D、△G<0,△S<0 |
氨分解反应在容积为2L的密闭容器内进行.已知起始时氨气的物质的量为4mol,5秒末为2.4mol,则用氨气表示该反应的速率为( )
| A、0.32 mol?L-1?s-1 |
| B、0.16 mol?L-1?s-1 |
| C、1.6 mol?L-1?s-1 |
| D、0.8 mol?L-1?s-1 |
设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A、常温常压下,8 g甲烷(CH4)中含有的碳原子数为2NA |
| B、标准状况下,0.3 mol CO2中含氧原子数为0.3NA |
| C、1 mol Na与足量水反应后转移的电子数为NA |
| D、1 mol?L-1MgCl2溶液中Cl一离子数为0.2NA |
下列物质属于有机物的是( )
| A、CaC2 |
| B、Na2CO3 |
| C、CO |
| D、CO(NH2)2 |