题目内容
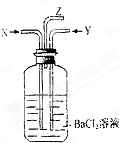 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )| A、洗气瓶中产生的沉淀是BaCO3 |
| B、在Z导管出来的气体中无CO2 |
| C、洗气瓶中产生的沉淀是BaSO3 |
| D、在Z导管口有红棕色气体出现 |
考点:二氧化硫的化学性质
专题:
分析:据反应,判断X为SO2和CO2,Y为NO2,生成NO2和SO2发生反应生成硫酸和NO,故有硫酸钡生成,由于硝酸的存在,二氧化碳与氯化钡不能生成碳酸钡沉淀从溶液中逸出.
解答:
解:X为SO2和CO2,Y为NO2,XY混合之后SO2和NO2会发生氧化还原反应:SO2 +NO2+H2O=H2SO4+NO
A、因H2SO4能与氯化钡反应生成BaSO4,CO2与氯化钡不反应,没有BaCO3生成,故A错误;
B、因CO2不与氯化钡反应,从导管中逸出,故B错误;
C、因H2SO4能与氯化钡反应生成BaSO4,故C错误;
D、反应生成的NO在Z导管口与空气中的氧气反应生成NO2,呈红棕色,故D正确;
故选D.
A、因H2SO4能与氯化钡反应生成BaSO4,CO2与氯化钡不反应,没有BaCO3生成,故A错误;
B、因CO2不与氯化钡反应,从导管中逸出,故B错误;
C、因H2SO4能与氯化钡反应生成BaSO4,故C错误;
D、反应生成的NO在Z导管口与空气中的氧气反应生成NO2,呈红棕色,故D正确;
故选D.
点评:本题主要考查了浓硫酸、浓硝酸的性质,根据物质的性质解释实验现象,培养了学生分析问题、解决问题的能力.

练习册系列答案
相关题目
下列图示对应的化学实验的基本操作,其中装置合理、操作规范的是( )

| A、甲装置可用于除去碳酸钠固体中含有的少量碳酸氢钠 |
| B、乙装置可用于碳酸钙固体和氯化钠溶液的分离 |
| C、丙装置可用于分离出I2的CCl4溶液 |
| D、丁装置可用于酒精和水的分离 |
反应3A(g)+B(g)?2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
| A、v (A)=0.15 mol?L-1?s-1 |
| B、v (B)=0.3 mol?L-1?s-1 |
| C、v (C)=0.5 mol?L-1?s-1 |
| D、v(D)=0.4 mol?L-1?s-1 |
对于反应2NO2(g)?N2O4(g)达到平衡后,在温度不变时欲使
比值增大,可以采取( )
| c(NO2) |
| c(N2O4) |
| A、体积不变,增加NO2的量 |
| B、体积不变,增加N2O4的量 |
| C、使体积扩大到原来的2倍 |
| D、使体积不变充入N2 |
在汽车尾气处理装置中加入适当的催化剂,能发生如下反应:4CO+2NO2═4CO2+N2.下列对该反应的说法中正确的是( )
| A、该反应是非氧化还原反应 |
| B、该反应中氧化剂是CO、还原剂是NO2 |
| C、该反应能减少汽车尾气对环境的污染 |
| D、该反应生成14g N2时,转移2mole- |
维生素C具有的性质错误的是( )
| A、难溶于水 | B、强还原性 |
| C、强氧化性 | D、加热易分解 |
下列关于气体摩尔体积的叙述中,正确的是( )
| A、1 mol任何气体的体积都约是22.4 L |
| B、标准状况时,氧气的体积约是22.4 L |
| C、1 molH2和1 molH2O在标准状况下体积都约是22.4 L |
| D、1 mol任何气体在标准状况下所占体积都约是22.4 L |
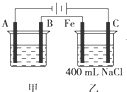 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答: