题目内容
在汽车尾气处理装置中加入适当的催化剂,能发生如下反应:4CO+2NO2═4CO2+N2.下列对该反应的说法中正确的是( )
| A、该反应是非氧化还原反应 |
| B、该反应中氧化剂是CO、还原剂是NO2 |
| C、该反应能减少汽车尾气对环境的污染 |
| D、该反应生成14g N2时,转移2mole- |
考点:氧化还原反应
专题:
分析:反应4CO+2NO2═4CO2+N2中,C元素化合价由+2价升高到+4价,被氧化,CO为还原剂,N元素化合价由+4价降低到0价,被还原,NO2为氧化剂,结合化合价的变化解答该题.
解答:
解:A.反应中C和N元素化合价发生变化,属于氧化还原反应,故A错误;
B.C元素化合价由+2价升高到+4价,被氧化,CO为还原剂,N元素化合价由+4价降低到0价,被还原,NO2为氧化剂,故B错误;
C.CO和NO等有害气体转化为无毒气体,可减少汽车尾气对环境的污染,故C正确;
D.该反应生成1molN2时,转移电子的物质的量为1mol×2×(4-0)=8mol,故D错误.
故选C.
B.C元素化合价由+2价升高到+4价,被氧化,CO为还原剂,N元素化合价由+4价降低到0价,被还原,NO2为氧化剂,故B错误;
C.CO和NO等有害气体转化为无毒气体,可减少汽车尾气对环境的污染,故C正确;
D.该反应生成1molN2时,转移电子的物质的量为1mol×2×(4-0)=8mol,故D错误.
故选C.
点评:本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握氧化还原反应的特征,从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
某无色溶液能与铝作用生成氢气,溶液中肯定能大量共存的离子组是( )
| A、Ba2+、Mg2+、NO3- |
| B、CO32-、Cl-、Mg2+ |
| C、Cl-、SO42-、K+ |
| D、Cu2+、Ca2+、Cl- |
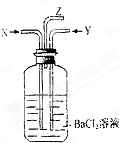 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列说法正确的是( )| A、洗气瓶中产生的沉淀是BaCO3 |
| B、在Z导管出来的气体中无CO2 |
| C、洗气瓶中产生的沉淀是BaSO3 |
| D、在Z导管口有红棕色气体出现 |
已知如下氧化还原反应2BrO3-+Cl2=Br2+2ClO3- 5Cl2+I2+6H2O=2HIO3+10HCl ClO3-+5Cl-+6H+=3Cl2+3H2O
则下列各微粒氧化能力强弱顺序正确的是( )
则下列各微粒氧化能力强弱顺序正确的是( )
| A、ClO3->BrO3->IO3->Cl2 |
| B、BrO3->Cl2>ClO3->IO3- |
| C、BrO3->ClO3->Cl2>IO3- |
| D、Cl2>BrO3->ClO3->IO3- |
加热NH4HCO3固体,使产生的气体依次通过盛有过量Na2O2的干燥管、浓H2SO4的洗气瓶,最后得到的气体是 ( )
| A、O2 |
| B、NH3 |
| C、CO2 |
| D、CO2和O2 |
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: