题目内容
11.设NA表示阿伏加德罗常数,下列说法正确的是 ( )| A. | 等质量的O2和O3在相同条件下所占的体积相同 | |
| B. | 电解精炼铜时,若转移6.02×1023个电子,则阳极溶解32g铜 | |
| C. | 1molCl2溶于足量水中,转移的电子数为NA | |
| D. | 2L 0.2mol•L-1硝酸与适量铁恰好完全反应(还原产物为NO),生成NO的分子数目为0.1NA |
分析 A.根据n=$\frac{m}{M}$计算物质的量之比,气体体积之比等于物质的量之比;
B、在电解精炼铜时,阳极上反应掉的不止是铜,还有比铜活泼的金属杂质;
C、氯气和水的反应为可逆反应;
D、根据铁和稀硝酸的反应来分析:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O.
解答 解:A.相同质量的O2和O3的物质的量之比为48g/mol:32g/mol=3:2,体积之比等于3:2,所以等质量的O2和O3在相同条件下所占的体积不相同,故A错误;
B、在电解精炼铜时,阳极上反应掉的不止是铜,还有比铜活泼的金属杂质,故当转移6.02X1023个电子,则阳极溶解铜小于32g,故B错误;
C、氯气和水的反应为可逆反应,故不能进行彻底,故1mol氯气和水的反应转移电子数小于NA个,故C错误;
D、0.2mol/L2L硝酸溶液中硝酸的物质的量n=CV=0.2mol/L×2L=0.4mol,而铁和稀硝酸的反应来分析:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,故当硝酸完全反应时,生成NO0.1mol,即0.1NA个NO分子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.

练习册系列答案
相关题目
5.磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3、Ca5(OH)(PO4)3]等形式存在.图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸.图(b)是热法磷酸生成过程中由磷灰石制单质磷的流程.

部分物质的相关性质如下:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑
、.现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85%的商品磷酸0.49吨.
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式)冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑
、.现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85%的商品磷酸0.49吨.
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式)冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
19.化学与资源、环境、生活关系密切,下列说法正确的是 ( )
| A. | 2015年中国诺贝尔生理学奖获奖者屠呦呦女士用乙醚从黄花蒿中提取青蒿素,该技术应用了分馏原理 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 生物炼铜原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| D. | 近日我国科学家成功制得反应物--超快正电子,正电子与负电子相遇就会湮灭并释放出极大的能量 |
6.下列实验装置能达到相应实验目的是( )
| A. | 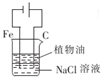 用图装置制取Fe(OH)2沉淀 | B. | 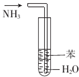 用图装置吸收NH3并防止倒吸 | ||
| C. | 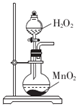 用图装置制取少量氧气 | D. | 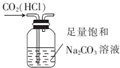 用图装置除去CO2中含有的少量HCl |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | Na2O2与足量CO2反应,共生成0.2mol O2,转移电子的数目为0.4NA | |
| B. | 室温下,1L pH=12的Ba(OH)2溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 0.1 mol聚丙烯中含有双键的数目为0.1NA | |
| D. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA |
20.下列说法不正确的是( )
| A. | 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构 | |
| B. | 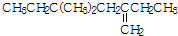 与氢气加成后的产物用系统命名法命名为3,5,5-三甲基庚烷 与氢气加成后的产物用系统命名法命名为3,5,5-三甲基庚烷 | |
| C. | 植物秸秆和土豆淀粉在一定条件下水解的产物都可以转化为酒精 | |
| D. | 完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同 |
1.化学知识在环境保护中起关键作用,下列叙述不正确的是( )
| A. | 在燃煤中加入适量的生石灰能有效减少二氧化硫的排放 | |
| B. | 控制含磷洗涤剂的生产和使用有利于防止水体富营养化 | |
| C. | 采用汽车尾气处理技术可将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 使用加酶洗衣粉,水温越高,洗涤效果更好 |
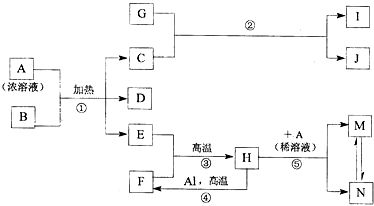
 ,化合物J的俗名纯碱.
,化合物J的俗名纯碱.
 .
.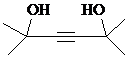 .
.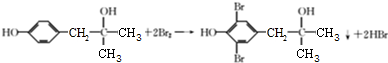 .
.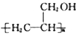 的合成路线图(无机试剂任用).合成路线图示例如下:
的合成路线图(无机试剂任用).合成路线图示例如下: