题目内容
17.三个密闭容器中进行同样的可逆反应:aX(g)+Y(g)═2Z(g);△H<0,均维持T℃和容器体积不变,2min时,甲容器达到平衡.以下描述正确的是( )| 甲 | 乙 | 丙 | |
| 容积 | 1L | 1L | 0.5L |
| 起始加入物质 | X:2mol,Y:1mol | Z:2mol | X:0.5mol,Y:0.25mol |
| 平衡时 | c(Z)=1.2mol•L-1 | c(Z)=1.2mol•L-1 |
| A. | T℃时该反应的平衡常数K为3.75 | |
| B. | 平衡时,X转化率:甲<丙 | |
| C. | 若乙是绝热容器,则平衡时,c(Z)>1.2mol•L-1 | |
| D. | 前2min内,丙容器中用X表示的平均反应速率v(X)=0.6mol•L-1 |
分析 均维持T℃和容器体积不变,达到平衡时甲乙两个容器中Z的浓度相等,说明两个平衡互为等效平衡,即加入2molZ相当于加入了2molX、1molY,据此可知a=2,
A.利用化学平衡三段式列式计算平衡时各组分的浓度,然后带入平衡常数表达式计算;
B.丙中X、Y的浓度为甲中的$\frac{1}{2}$,相当于减小压强,平衡向着逆向移动,导致X的转化率减小;
C.甲乙若在恒温恒容条件下互为等效平衡,平衡常时c(Z)=1.2mol•L-1,结合Z的分解反应为吸热反应判断平衡时Z的浓度变化;
D.结合B可知,丙中平衡时c(Z)<0.6mol•L-1,根据v=$\frac{△c}{△t}$计算出甲中用Z表示的反应速率,然后利用化学反应速率与化学计量数成正比计算出X的速率.
解答 解:均维持T℃和容器体积不变,达到平衡时甲乙两个容器中Z的浓度相等,说明两个平衡互为等效平衡,即加入2molZ相当于加入了2molX、1molY,据此可知a:1:2=2:1:2,则a=2,
A.2X(g)+Y(g)═2Z(g),
初始(mol/L)2 1 0
转化(mol/L)1.2 0.6 1.2
平衡(mol/L)0.8 0.4 1.2
T℃时该反应的平衡常数为:K=$\frac{1.{2}^{2}}{0.8×0.4}$=4.5,故A错误;
B.丙中X、Y的浓度为甲中X、Y浓度的$\frac{1}{2}$,在恒容恒温条件下,相当于将丙中压强减小,平衡向着气体体积增大的逆向移动,导致丙中X的转化率减小,则平衡时X的转化率:甲>丙,故B错误;
C.若在恒温恒容条件下,甲乙互为等效平衡,平衡时c(Z)=1.2mol•L-1,若乙是绝热容器,Z转化成X、Y的反应为吸热反应,降低温度平衡向着放热的方向(即生成Z的方向)移动,导致Z的浓度增大,即c(Z)>1.2mol•L-1,故C正确;
D.结合B可知,丙中平衡时c(Z)<0.6mol•L-1,则v(Z)<$\frac{0.6mol/L}{2min}$=0.3mol•L-1,则丙中v(X)=v(Z)<0.3mol•L-1,故D错误;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,正确判断甲乙互为等效平衡为解答关键,注意掌握化学反应速率、转化率、化学平衡常数的概念及表达式,试题培养了学生的分析能力及化学计算能力.

| A. | ②③④① | B. | ④①②③ | C. | ①④②③ | D. | ③②①④ |
 合成氨工业上常用下列方法制备H2:
合成氨工业上常用下列方法制备H2:方法①:C(s)+2H2O(g)?CO2(g)+2H2(g)
方法②:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)已知①C(石墨)+O2(g)═CO2(g)△H=-394kJ•mol-1
②2C(石墨)+O2(g)═2CO(g)△H=-222kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1
试计算25℃时由方法②制备1000gH2所放出的能量为20500kJ.
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)其相关数据如表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是大于0.8mol/L,小于1.4mol/L.
③在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)=2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均摩尔质量保持不变
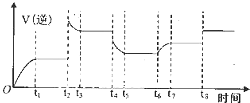
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,从t1到t8哪个时间段H2O(g)的平衡转化率最低t7-t8.
| A. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 断开化学键的过程会放出能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 酸碱中和反应都是吸热反应 |
 .
.

 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
 .
.