题目内容
17.下列有关说法正确的是( )| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化[2SO2(g)+O2(g)?2SO3 (g)],不采用高压是因为压强对SO2转化率无影响 |
分析 A、根据化学反应能否自发进行的判断依据判断;
B、依据溶液中离子积常数分析判断;
C、钢闸门和铜在电解质溶液中形成原电池,铁做负极失电子被氧化;
D、压强对化学反应前后气体体积变化的反应的平衡移动有影响.
解答 解:A、化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发,所以焓变和熵变都不能独立地作为反应自发性的判据,故A错误;
B、同温、同浓度的盐酸和氢氧化钠稀溶液中,氢离子和氢氧根离子浓度相同,对水的电离抑制程度相同,水的电离程度相同,故B正确;
C、钢闸门和铜在电解质溶液中形成原电池,铁做负极失电子被氧化腐蚀,故C错误;
D、二氧化硫的催化氧化不采用高压是考虑设备的耐压程度,压强对化学平衡会产生影响,增大压强,有利于二氧化硫的转化,故D错误.
故选B.
点评 本题考查了反应自发进行的判断依据,水的电离影响因素分析,金属保护原理的分析应用,平衡移动原理分析,题目难度中等.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
19.短周期主族元素M、N、X、Y、Z的原子序数依次增大.M、X同主族,N原子的最外层电子数是电子层数的3倍,M原子的半径小于N原子的半径,Y原子的电子层数与最外层电子数相等,Z原子的最外层电子数等于N、X原子的最外层电子数之和.下列叙述正确的是( )
| A. | 单质的还原性:Y>X | |
| B. | 元素M与N只能形成一种化合物 | |
| C. | 元素Z的单质不能与元素N的氢化物反应 | |
| D. | 元素X、Y的最高氧化物对应的水化物可发生反应 |
8.下列说法正确的是( )
| A. | 发生了颜色变化的一定是化学变化 | |
| B. | 有气泡产生或固体析出的变化一定是化学变化 | |
| C. | 用糯米、酒曲和水制成甜酒酿一定是化学变化 | |
| D. | 氧化还原反应中肯定有一种元素被氧化,而另一种元素被还原 |
2.下列有关说法中,不正确的是( )
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 | |
| C. | 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液 | |
| D. | 焰火的五彩缤纷是某些金属元素的性质的表现 |
6.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
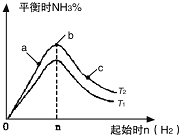 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.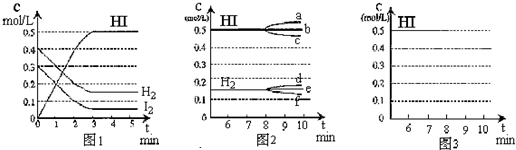
 对叔丁基苯酚
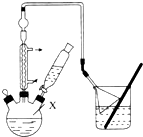
对叔丁基苯酚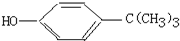 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CC1]等为原料制备对叔丁基苯酚,已知叔丁基氯熔点(℃)-25.4沸点(℃):51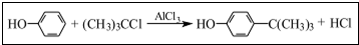 .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.