题目内容
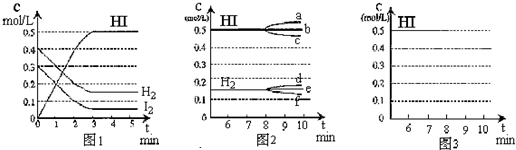
9.在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)△H<0反应中各物质的浓度随时间变化情况如图1:(1)该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(HI)}{c({H}_{2})c({I}_{2})}$;
(2)根据图1数据,该反应达到平衡时,H2(g)的转化率为62.5%;
(3)能说明反应达到平衡状态的是C;
A.v正(H2)=2v逆(HI) B.容器中的压强不变
C.混合气体中C(I2)不变 D.容器内的密度不变
(4)若H2(g)、I2(g)、HI(g)的起始浓度分别用amol•L-1、bmol•L-1、cmol•L-1表示,达到平衡时各组分的浓度和图1的平衡状态相同,则a、b的应满足a+$\frac{c}{2}$=0.4、b+$\frac{c}{2}$=0.3.
(5)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K减小(填写增大、减小或不变),HI浓度的变化正确的是c.(用图2中a~c的编号回答)
②若加入I2,H2浓度的变化正确的是f.(用图2中d~f的编号回答)
(6)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况.
分析 (1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
(2)由图象判断消耗氢气的量,可计算转化率;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(4)若H2(g)、I2(g)、HI(g)的起始浓度分别用amol•L-1、bmol•L-1、cmol•L-1表示,达到平衡时各组分的浓度和图1的平衡状态相同;
(5)①根据化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,生成物浓度增大,反之,若平衡逆向移动,化学平衡常数K减少,生成物浓度减少;
②若加入I2,平衡正向移动,H2浓度减少;
(6)反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小.
解答 解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=$\frac{{c}^{2}(HI)}{c({H}_{2})c({I}_{2})}$,故答案为:K=$\frac{{c}^{2}(HI)}{c({H}_{2})c({I}_{2})}$;
(2)由图象可知达到平衡时生成0.5molHI,则消耗0.25molH2,H2(g)的转化率为$\frac{0.25mol}{0.4mol}×100%$=62.5%,
故答案为:62.5%;
(3)A.v正(H2)=2v逆(HI),正逆反应速率不等,没有达到平衡状态,故A错误;
B.反应前后气体的体积不变,故容器总压强不随时间改变不能作为判断是否达到化学平衡状态的依据,故B错误;
C.混合气体中C(I2)不变,可说明达到平衡状态,故C正确;
D.都是气体参加反应,质量不变,体积不变,则密度不变,不能判断是否达到平衡状态,故D错误.
故选C;
(4)若H2(g)、I2(g)、HI(g)的起始浓度分别用amol•L-1、bmol•L-1、cmol•L-1表示,达到平衡时各组分的浓度和图1的平衡状态相同,则HI转化为碘、氢气与初始量相同,应满足a+$\frac{c}{2}$=0.4、b+$\frac{c}{2}$=0.3,
故答案为:a+$\frac{c}{2}$=0.4、b+$\frac{c}{2}$=0.3;
(5)①该反应放热,升高温度,平衡逆向移动,化学平衡常数K减少,生成物浓度减少,故答案为:减小;c;
②若加入I2,平衡正向移动,H2浓度减少,故答案为:f;
(6)H2(g)+I2(g)?2HI(g),反应是体积不变的反应,改变压强平衡不动,容器的容积扩大一倍,平衡物质浓度减小,碘化氢浓度减小一半为0.25mol/L,画出的变化图象如图: ,故答案为:
,故答案为: .
.
点评 本题主要考查了平衡常数、化学平衡移动以及化学反应速率的计算,为高考常见题型,难度较大,需要注意的是:化学平衡常数K只与温度有关,温度改变,若平衡正向移动,化学平衡常数K增大,反之则减少.

 天天练口算系列答案
天天练口算系列答案| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 | |
| B. | 乙和甲中同种元素的质量分数相等,则乙能使湿润的KI淀粉试纸变蓝 | |
| C. | 丙中含有ⅣA族元素,则相同条件下丙比甲稳定 | |
| D. | 若丁分子空间构型为三角锥型,则丁分子间存在氢键 |
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化[2SO2(g)+O2(g)?2SO3 (g)],不采用高压是因为压强对SO2转化率无影响 |
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 经常使用一次性筷子、纸杯、塑料袋等做法能保护环境 |
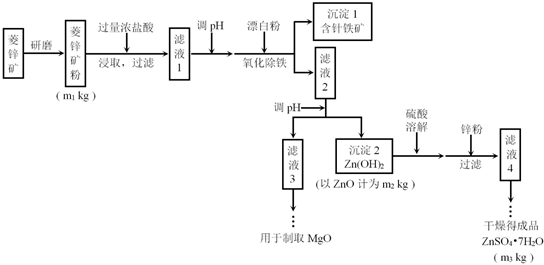
(1)加过量稀盐酸的目的是提高锌元素的浸出率.
(2)完成“氧化除铁”步骤中反应的离子方程式:
2Fe(OH)2+ClO-+H2O═2Fe(OH)3+1Cl-
(3)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)分析流程图中的数据,菱锌矿粉中ZnCO3的质量分数不低于$\frac{125m2}{81m1}$×100%.
| A. | “哑泉”之毒是由于水中的Cu2+使人体中的蛋白质分解 | |
| B. | “哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性 | |
| C. | “哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性 | |
| D. | “安乐泉”能解“哑泉”之毒的离子方程式为Cu2++2OH-=Cu(OH)2↓ |
 ,它是由Na+与O22-(填写离子符号)构成的.
,它是由Na+与O22-(填写离子符号)构成的.