题目内容
19.短周期主族元素M、N、X、Y、Z的原子序数依次增大.M、X同主族,N原子的最外层电子数是电子层数的3倍,M原子的半径小于N原子的半径,Y原子的电子层数与最外层电子数相等,Z原子的最外层电子数等于N、X原子的最外层电子数之和.下列叙述正确的是( )| A. | 单质的还原性:Y>X | |
| B. | 元素M与N只能形成一种化合物 | |
| C. | 元素Z的单质不能与元素N的氢化物反应 | |
| D. | 元素X、Y的最高氧化物对应的水化物可发生反应 |
分析 短周期主族元素M、N、X、Y、Z的原子序数依次增大,N原子的最外层电子数是电子层数的3倍,N只能含有2个电子层,说明N最外层含有6个电子,为O元素;M原子的半径小于N原子的半径,M的原子序数小于N,则M处于第一周期,为H元素;Y原子的电子层数与最外层电子数相等,Y处于第三周期,则Y为Al元素;M、X同主族,则X为ⅠA族元素,原子序数大于O、小于Al,则X为Na元素;Z原子的最外层电子数等于N、X原子的最外层电子数之和,则Z最外层含有电子数为:6+1=7,则Z为Cl元素,据此结合元素周期律知识进行解答.
解答 解:N原子的最外层电子数是电子层数的3倍,N只能含有2个电子层,说明N最外层含有6个电子,为O元素;M原子的半径小于N原子的半径,M的原子序数小于N,则M处于第一周期,为H元素;Y原子的电子层数与最外层电子数相等,Y处于第三周期,则Y为Al元素;M、X同主族,则X为ⅠA族元素,原子序数大于O、小于Al,则X为Na元素;Z原子的最外层电子数等于N、X原子的最外层电子数之和,则Z最外层含有电子数为:6+1=7,则Z为Cl元素,
根据分析可知,M、N、X、Y、Z分别为H、O、Na、Al、Cl元素,
A.X为Na、Y为Al,则还原性Na>Al,即:X>Y,故A错误;
B.M、N分别为H、O元素,二者可以形成水和双氧水两种化合物,故B错误;
C.元素Z的单质为钠,元素N的氢化物为水,钠能够与水反应生成氢氧化钠和氢气,故C错误;
D.元素X、Y的最高氧化物对应的水化物分别为NaOH、氢氧化铝,二者反应生成偏铝酸钠和水,故D正确;
故选D.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系及应用方法,试题培养了学生的逻辑推理能力.

| A. | 水 | B. | 溴水 | C. | 紫色石蕊溶液 | D. | 四氯化碳 |
| A. | 硫原子结构示意图: | |
| B. | 氯化氢分子的电子式: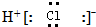 | |
| C. | 乙烯分子的结构式:CH2=CH2 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=2 Fe3++3SO42ˉ |
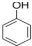
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 | |
| B. | 乙和甲中同种元素的质量分数相等,则乙能使湿润的KI淀粉试纸变蓝 | |
| C. | 丙中含有ⅣA族元素,则相同条件下丙比甲稳定 | |
| D. | 若丁分子空间构型为三角锥型,则丁分子间存在氢键 |
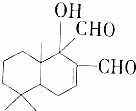
| A. | 既能发生氧化反应,又能发生酯化反应 | |
| B. | 与FeC13溶液发生反应后,溶液显紫色 | |
| C. | 1mol该有机物最多可与2molCu(0H)2反应 | |
| D. | 1mol该有机物最多可与1molH2加成 |
| A. | △H>0的反应一定不能自发进行 | |
| B. | 同温、同浓度的盐酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| C. | 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 | |
| D. | 硫酸工业中二氧化硫的催化氧化[2SO2(g)+O2(g)?2SO3 (g)],不采用高压是因为压强对SO2转化率无影响 |
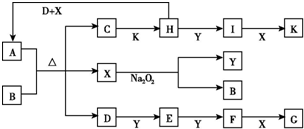 如图所示的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.试回答下列问题:
如图所示的转化关系中,已知A是由短周期元素组成的酸式盐.D、Y、H为气体,X为无色液体,G和K均是常见的强酸.H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.试回答下列问题: c.
c.