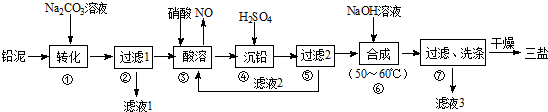
题目内容
2. 某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )
某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )| A. | 该有机物遇氯化铁溶液不呈紫色 | |
| B. | 1mol该有机物能与6mol氢氧化钠反应 | |
| C. | 该有机物能与6mol金属钠反应生成6molH2 | |
| D. | 在稀硫酸存在下可以发生水解反应,但水解的产物只有一种有机物 |
分析 由结构简式可知,分子中含酚-OH、-COOH、-COOC-,结合酚、羧酸及酯的性质来解答.
解答 解:A.含有酚羟基,可与氯化铁溶液发生颜色反应,故A错误;
B.该有机物水解产物共含有6个酚羟基和2个羧基,则1 mol该有机物在一定条件下,最多能与8molNaOH反应,故B错误;
C.分子中含有5个羟基和1个羧基,则可与6mol金属钠反应生成3molH2,故C错误;
D.-COOC-水解,水解产物只有一种,水解产物为 ,故D正确.
,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,注意有机物官能团的性质,根据有机物的结构简式判断有机物含有的官能团的种类和性质为解答该题的关键,注意水解产物,题目难度不大.

练习册系列答案
相关题目
12.关于SO2的叙述中正确的是( )
| A. | SO2通入氯水后,溶液褪色且酸性减弱 | |
| B. | 是酸性氧化物,溶于水得稳定的亚硫酸 | |
| C. | SO2气体通入NaOH溶液一定得到Na2SO3 | |
| D. | S、SO2、SiO2三种物质均能与NaOH溶液反应,各自又能与某些酸反应 |
13.下列关于测定1mol氢气体积的操作中,错误的是( )
| A. | 保证装置不漏气 | |
| B. | 镁带称量后,用砂皮擦去表面的氧化层 | |
| C. | 用针筒注入硫酸后,拔出速度要快 | |
| D. | 镁带的质量要使产生的氢气足以计量 |
10.下列有关元素性质比较正确的是( )
| A. | 氢化物稳定性:PH3>H2S>HCl | B. | 沸点:H2O>HF>HCl | ||
| C. | 原子半径:S>F>O | D. | 酸性:HClO>HNO3>H2CO3 |
17.将过量的二氧化碳分别通入下列溶液,最终溶液中有沉淀析出的是( )
| A. | 氯化钙溶液 | B. | 硅酸钠溶液 | C. | 澄清石灰水 | D. | 饱和碳酸钠溶液 |
7.下列说法正确的是( )
| A. | Na2O2与H2O反应过程中有离子键、非极性键、极性键的断裂和形成 | |
| B. | 1molNH4+中含有的共用电子对为3mol | |
| C. | N2属于单质,不存在化学键 | |
| D. | 离子化合物中一定含有金属元素 |
14.标号为①~⑩的元素,在元素周期表中的位置如下:
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是H、F、Cl(填写元素符号).
(2)①和④号元素形成的化合物的化学式为NH3,用电子式表示其形成过程为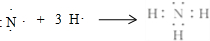 .
.
(3)⑧号元素的最高价氧化物的水化物的化学式是Mg(OH)2.
(4)①、⑤、⑦号元素形成的一种化合物的电子式是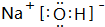 ,在该化合物中既含有离子键,又含有共价键.
,在该化合物中既含有离子键,又含有共价键.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是H、F、Cl(填写元素符号).
(2)①和④号元素形成的化合物的化学式为NH3,用电子式表示其形成过程为
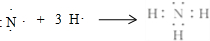 .
.(3)⑧号元素的最高价氧化物的水化物的化学式是Mg(OH)2.
(4)①、⑤、⑦号元素形成的一种化合物的电子式是
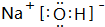 ,在该化合物中既含有离子键,又含有共价键.
,在该化合物中既含有离子键,又含有共价键.
18.把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为( )
| A. | 1.0 mol/L | B. | 2.0 mol/L | C. | 3.0 mol/L | D. | 4.0 mol/L |